Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO  uBio
uBio
Compartir
InVet
versión On-line ISSN 1668-3498
InVet vol.16 no.2 Ciudad Autónoma de Buenos Aires dic. 2014
ARTÍCULO DE INVESTIGACIÓN
El espermatozoide criopreservado bovino es capaz de modular su requerimiento energético dependiendo de los sustratos oxidativos disponibles para la capacitación inducida in vitro con heparina.*
Fernández, S.1; Córdoba, M.1
1Cátedra de Química Biológica, Instituto de Investigación y Tecnología en Reproducción Animal (INITRA), Facultad de Ciencias Veterinarias, Universidad de Buenos Aires. Av. Chorroarín 280 (1427), Ciudad Autónoma de Buenos Aires, Argentina. *Mención Accesit en el marco del Premio Estímulo a la Investigación Científica de FCV-UBA 2014
Correspondencia e-mail: Mariana Córdoba mcordoba@fvet.uba.ar
Recibido: 24/09/2014
Aceptado: 22/12/2014
Resumen
El objetivo de este trabajo fue estudiar en espermatozoides criopreservados de bovino, los requerimientos de sustratos oxidativos durante la capacitación inducida por heparina. Se determinó el porcentaje de espermatozoides capacitados por medio de la tinción epifluorescente de clorotetraciclina, viabilidad e integridad acrosomal por la coloración vital de azul tripán y microscopia óptica de contraste diferencial interferencial, la variación de concentración de lactato en el medio de incubación por espectrofotometría y el consumo de oxígeno celular por polarografía, en presencia de lactato y/o piruvato como sustratos oxidativos. Los porcentajes de espermatozoides capacitados con heparina incubados con lactato/piruvato o piruvato como sustratos oxidativos fueron significativamente mayores respecto a los demás tratamientos. La viabilidad e integridad acrosomal evidenció una disminución en ausencia de sustratos en todos los tratamientos. En muestras capacitadas con heparina ante la presencia de lactato/piruvato el consumo de oxígeno fue significativamente superior, registrándose una disminución de la concentración de lactato en el medio de incubación respecto a sus controles. La combinación de los sustratos oxidativos lactato/piruvato es la mejor opción para mantener la viabilidad espermática, producir un burst respiratorio y un alto porcentaje de espermatozoides capacitados, asegurando un metabolismo activo en la gameta para cubrir los requerimientos energéticos de la capacitación.
Palabras clave: Espermatozoide bovino; Capacitación; Sustratos oxidativos; Metabolismo.
Cryopreserved bovine spermatozoa is capable to modulate its energy requirement depending on oxidative substrates to induce heparin capacitation in vitro
Summary
The aim of this investigation was to study in cryopreserved bovine sperm the requirements of oxidative substrates during heparin-induced capacitation. Percentages of capacitated sperm and viability and acrosome integrity were evaluated by chlortetracycline epifluorescent technique and Trypan blue stain/DIC, respectively and lactate concentration changes in the incubation medium were registered spectrophotometrically and cellular oxygen consumption polarographically, in the presence of lactate and/or pyruvate as oxidative substrates. Percentages of capacitated spermatozoa incubated with heparin and lactate/pyruvate or pyruvate as oxidative substrates were significantly higher compared to the other treatments. The viability and acrosomal integrity significantly decreased in the absence of substrates in all treatments. In heparin capacitated sperm in the presence of lactate/pyruvate, oxygen consumption was significantly higher compared to the other treatments. Lactate concentration in the incubation medium, in the presence of lactate or lactate/pyruvate and heparin, showed a decrease respect to control. The combination of oxidative substrates lactate/pyruvate is the best option to maintain sperm viability, respiratory burst and produce a high percentage of capacitated sperm, ensuring an active metabolism in the gamete to cover the energy requirements of capacitation.
Key words: Bovine spermatozoa; Capacitation; Oxidative substrates; Metabolism.
Introducción
Los espermatozoides de los mamíferos no son capaces de fertilizar al ovocito luego de la eyaculación, es por ello que requieren de un proceso de maduración dentro del tracto genital femenino, conocido como capacitación espermática3. Durante la capacitación se producen alteraciones bioquímicas y ultraestructurales que modifican la fluidez de la membrana plasmática, la concentración de calcio intracelular, la fosforilación de proteínas en tirosina, la actividad de proteína quinasas A, C y tirosina quinasa y los patrones de motilidad, eventos dependientes de la carga energética de esta célula haploide. La capacitación le confiere a la gameta masculina la habilidad de adquirir una motilidad hiperactiva, interactuar con la zona pelúcida, desencadenar la reacción acrosomal e iniciar la fusión con la membrana plasmática del ovocito32.
Muchos inductores de la capacitación in vivo e in vitro han sido descriptos para provocar los cambios mencionados anteriormente. En el bovino se destaca el uso de la heparina como inductor fisiológico para la fertilización in vitro29. La heparina es un glicosaminoglicano presente en el tracto genital de la hembra bovina22. Este polisacárido sulfatado está formado por unidades de ácido D-glucurónico o ácido L-idurónico y N-acetil-D-glucosamina. Tradicionalmente la heparina es utilizada como un inductor fisiológico de la capacitación espermática en diversas especies como el bovino27, el porcino12, y el equino1. En el bovino ha sido demostrado que la incubación de espermatozoides eyaculados con heparina incrementa el porcentaje de ovocitos fertilizados29, y se comprobó que la heparina promueve la capacitación, el incremento de pH y de la concentración de calcio intracelular10,28, la fosforilación de proteínas y la modificación de los parámetros de motilidad7.
El espermatozoide bovino puede utilizar diferentes sustratos oxidativos para producir la energía necesaria para el metabolismo espermático. La presencia de sustratos oxidativos es fundamental para los procesos de capacitación y reacción acrosomal2. Se ha evidenciado un alto porcentaje de fertilización in vitro de ovocitos bovinos cuando los espermatozoides utilizados fueron incubados con piruvato, lactato y glucosa como sustratos oxidativos8,11. El lactato in vivo está presente en el fluido seminal y en las secreciones del tracto genital femenino en altas concentraciones, y puede ser utilizado como metabolito oxidativo por el espermatozoide humano23 y el bovino2. El piruvato, también presente en el tracto genital femenino, es utilizado como sustrato oxidativo en el espermatozoide humano19.
En la célula espermática la mayor parte del ATP producido es utilizado para sostener energéticamente la motilidad, la cual es esencial para la fertilización21. Además de proporcionar energía para que el espermatozoide llegue al sitio de fertilización en el oviducto, el ATP puede también activar señales moleculares incrementando la frecuencia de batido flagelar y ayudando a mover la gameta a través del oviducto o salir del reservorio oviductal en el bovino15. Se ha reportado que las mitocondrias juegan un rol importante en la producción de energía y en el mantenimiento del estado redox del espermatozoide bovino criopreservado, en donde se registró que la capacitación con heparina genera un burst respiratorio8. La funcionalidad de las mitocondrias depende de la integridad de sus membranas y del acoplamiento de la fosforilación oxidativa y el transporte de electrones hacia el oxígeno, para que puedan proveer energía a la célula2.
El objetivo de este trabajo fue estudiar la combinatoria más adecuada de sustratos oxidativos que cubran los requerimientos energéticos de la capacitación inducida por heparina en espermatozoides criopreservados de bovino, a través de la determinación de los porcentajes de capacitación espermática, viabilidad e integridad acrosomal, la variación de concentración de lactato en el medio de incubación y el consumo de oxígeno celular en presencia de lactato y/o piruvato como sustratos oxidativos.
Materiales y métodos
Descongelamiento de las muestras espermáticas
Se utilizaron muestras de semen congelado de toros Holando-Argentino de probada fertilidad obtenidas con vagina artificial provenientes de un centro de inseminación artificial. Las muestras se descongelaron durante 10 minutos a 37°C en medio TALP (NaCl 100 mM, KCl 3 mM, NaH2PO4 0,3 mM, NaHCO3 10 mM, Hepes 40 mM, MgSO4 1,5 mM) sin albúmina sérica bovina (BSA) o calcio. Luego de evaluar la motilidad y el vigor, las muestras se centrifugaron a 2000 rpm durante 5 minutos y se resuspendieron en medio TALP con CaCl2 2,1 mM y BSA 6 mg/ml a 38°C. Para evaluar el efecto de los distintos sustratos oxidativos, se modificó la composición del medio TALP con el agregado de lactato 22 mM y/o piruvato de sodio 1,2 mM. Por microscopía óptica en platina térmica a 38°C se determinó el porcentaje de motilidad progresiva y el vigor (0 a 4)4. Se consideraron para realizar las experiencias muestras espermáticas que presentaban una motilidad progresiva de 60 % o superior y un vigor entre 3-4.
Inducción de la capacitación
Las muestras espermáticas se capacitaron con heparina (60 mg/ml)14,29 durante 15 minutos de incubación.
Determinación del consumo de oxígeno
El consumo de oxígeno se determinó polarográficamente a 38ºC con un electrodo de oxígeno modificado tipo Clark y un oxígrafo Instech Laboratories (Philadelphia, PA, USA). Carbanil-cianuro-m-cloro fenilhidrazona (CCCP 0,42 μM) se utilizó como un desacoplante específico de la cadena respiratoria. La concentración final utilizada en la cubeta fue de 1 x 108 espermatozoides/ml. El consumo de oxígeno se expresó como μLO2/h/108 espermatozoides30.
Evaluación de la viabilidad y la integridad acrosomal por la coloración vital de azul tripán y microscopia óptica de contraste diferencial interferencial
Las muestras espermáticas fueron teñidas con la coloración vital de azul tripán y observadas con microscopia óptica de contraste diferencial interferencial (DIC) para determinar, al mismo tiempo, el porcentaje de espermatozoides vivos y la integridad acrosomal15. Los patrones observados en espermatozoides bovinos son: 1) Vivos intactos: espermatozoides transparentes y con el acrosoma intacto; 2) Vivos no intactos: espermatozoides transparentes y con el acrosoma dañado; 3) Muertos intactos: espermatozoides azules y con el acrosoma intacto y 4) Muertos no intactos: espermatozoides azules y con el acrosoma dañado.
Evaluación de la capacitación por la coloración espermática epifluorescente de clorotetraciclina
Los porcentajes de espermatozoides capacitados y reaccionados se determinaron por la coloración espermática epifluorescente de clorotetraciclina (CTC)4,10. Se evaluaron los distintos patrones espermáticos utilizando un microscopio de epifluorescencia Carl Zeiss Jenamed 2. Tres patrones de clorotetraciclina fueron observados en el espermatozoide bovino: 1) intacto no capacitado: con cabeza fluorescente; 2) intacto capacitado: con banda sin fluorescencia en la región post acrosomal y 3) reaccionado: con acrosoma reaccionado presentando baja fluorescencia en todo el espermatozoide excepto por una banda en el segmento ecuatorial. En todos los patrones se observa la fluorescencia de la parte intermedia del flagelo.
Medición de lactato
El lactato presente en el medio de incubación se midió usando un kit diagnóstico (Hitachi 912; Roche Diagnostic - Trinity Biotech, Procedure No. 735, Wicklow, Ireland). Con este método la enzima lactato oxidasa cataliza la oxidación de lactato a piruvato y H2O2. La peroxidasa cataliza la condensación oxidativa de precursores cromógenos a partir del H2O2 producido, obteniendo un compuesto coloreado. Con una absorción máxima de 660 nm y a 37ºC, la concentración del compuesto coloreado es directamente proporcional a la concentración de lactato de la muestra20. Esta medición se realiza en referencia al lactato en el medio de incubación cuya variación depende del metabolismo de la gameta. La concentración de lactato presente en el medio de incubación se expresó en mM de lactato/106 espermatozoides.
Análisis estadístico
Los resultados se expresaron como promedio ± desvío estándar y fueron evaluados por el programa STATISTIX Version 7.0 (Analytical Software for Windows, Tallahassee, FL, USA). Los datos fueron evaluados mediante un Análisis de Varianzas (ANOVA) y un post-ANOVA, a través de la comparación de medias con el test de Tukey, considerando en todos los casos (p<0,05) para establecer diferencias significativas.
Resultados
Espermatozoides de bovino congeladosdescongelados fueron incubados con diferentes combinatorias de sustratos oxidativos: lactato/ piruvato, lactato, piruvato y en ausencia de los mismos. Para cada tratamiento se determinó en las muestras espermáticas el porcentaje de capacitación y de viabilidad e integridad acrosomal, el consumo de oxígeno y la variación de la concentración de lactato en el medio de incubación.
En muestras tratadas con heparina e incubadas con lactato/piruvato o piruvato como sustratos oxidativos, los porcentajes de espermatozoides capacitados fueron significativamente mayores respecto a los demás tratamientos (p<0,05). Gráfico 1.
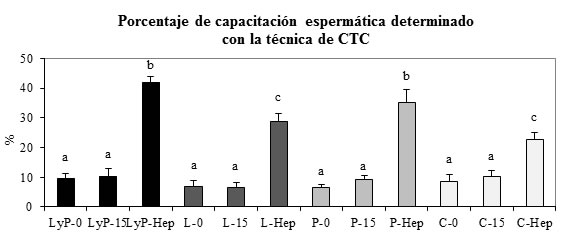
Gráfico 1. Porcentaje de espermatozoides capacitados con diferentes sustratos oxidativos. Porcentaje de espermatozoides capacitados utilizando diferentes sustratos oxidativos en el medio de incubación, determinado con la técnica epifluorescente de clorotetraciclina (CTC). LyP-0: control 0 minutos de incubación con lactato y piruvato; LyP-15: control 15 minutos de incubación con lactato y piruvato; LyP-Hep: heparina 15 minutos de incubación con lactato y piruvato; L-0: control 0 minutos de incubación con lactato; L-15: control 15 minutos de incubación con lactato; L-Hep: muestras de espermatozoides incubados con heparina durante 15 minutos con lactato; P-0: control 0 minutos de incubación con piruvato; P-15: control 15 minutos de incubación con piruvato; P-Hep: muestras de espermatozoides incubados con heparina durante 15 minutos con piruvato; C-0: control 0 minutos de incubación sin sustratos oxidativos; C-15: control 15 minutos de incubación sin sustratos oxidativos; C-Hep: muestras de espermatozoides incubados con heparina durante 15 minutos sin sustratos oxidativos. Las letras indican diferencias significativas entre los tratamientos (P<0,05) .
La viabilidad e integridad acrosomal de las muestras se mantuvo sin diferencias significativas en todos los tratamientos con las distintas combinatorias de sustratos oxidativos con respecto a sus controles de incubación (p>0,05). Se evidenció una disminución de la viabilidad e integridad acrosomal en ausencia de sustratos oxidativos (p<0,05). Gráfico 2.
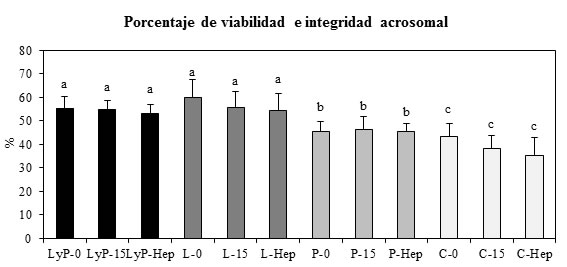
Gráfico 2. Viabilidad e integridad acrosomal con diferentes sustratos oxidativos. Porcentaje de espermatozoides vivos y con integridad acrosomal en la capacitación con heparina y ácido hialurónico, determinados con la tinción de azul tripán y contraste diferencial interferencial (Azul tripán/DIC). LyP-0: control 0 minutos de incubación con lactato y piruvato; LyP-15: control 15 minutos de incubación con lactato y piruvato; LyP-Hep: muestras de espermatozoides incubados con heparina durante 15 minutos con lactato y piruvato; L-0: control 0 minutos de incubación con lactato; L-15: control 15 minutos de incubación con lactato; L-Hep: muestras de espermatozoides incubados con heparina durante 15 minutos con lactato; P-0: control 0 minutos de incubación con piruvato; P-15: control 15 minutos de incubación con piruvato; P-Hep: muestras de espermatozoides incubados con heparina durante 15 minutos con piruvato; C-0: control 0 minutos de incubación sin sustratos oxidativos; C-15: control 15 minutos de incubación sin sustratos oxidativos; C-Hep: muestras de espermatozoides incubados con heparina durante 15 minutos sin sustratos oxidativos. Las letras indican diferencias significativas entre los tratamientos (P<0,05).
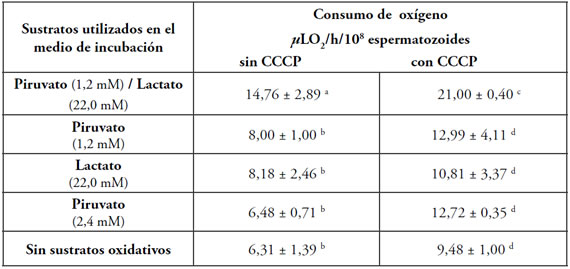
La medición de consumo de oxígeno, en muestras capacitadas con heparina, permitió observar que ante la presencia de lactato/ piruvato, la respiración fue significativamente superior con respecto a los otros tratamientos (p<0,05). Tabla 1.
Tabla 1. Consumo de oxígeno espermático con diferentes sustratos oxidativos en el medio de incubación. El consumo de oxígeno de las suspensiones espermáticas con los diferentes sustratos oxidativos con y sin el agregado de un desacoplante de cadena respiratoria (CCCP) fue determinado por polarografía y se expresó en µLO2/h/108 espermatozoides. El tamaño de la muestra fue de n=7. Las letras indican diferencias significativas entre los tratamientos (P<0,05).
En presencia de lactato o lactato/piruvato como sustratos oxidativos en muestras tratadas con heparina, la concentración de lactato en el medio de incubación disminuyó con respecto a sus controles. En muestras incubadas sólo con piruvato con y sin presencia del inductor de la capacitación heparina, se registró una disminución de la concentración de lactato en el medio de incubación (p<0,05). Gráfico 3.
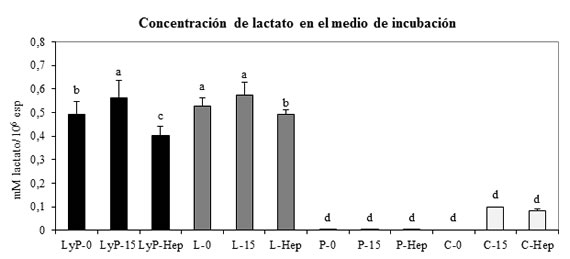
Gráfico 3. Concentración de lactato en el medio de incubación con diferentes sustratos oxidativos. La concentración de lactato en el medio de incubación fue determinada por espectrofotometría y se expresó en mM lactato/106 espermatozoides. LyP-0: control 0 minutos de incubación con lactato y piruvato; LyP-15: control 15 minutos de incubación con lactato y piruvato; LyP-Hep: muestras de espermatozoides incubados con heparina durante 15 minutos con lactato y piruvato; L-0: control 0 minutos de incubación con lactato; L-15: control 15 minutos de incubación con lactato; L-Hep: muestras de espermatozoides incubados con heparina durante 15 minutos con lactato; P-0: control 0 minutos de incubación con piruvato; P-15: control 15 minutos de incubación con piruvato; P-Hep: muestras de espermatozoides incubados con heparina durante 15 minutos con piruvato; C-0: control 0 minutos de incubación sin sustratos oxidativos; C-15: control 15 minutos de incubación sin sustratos oxidativos; C-Hep: muestras de espermatozoides incubados con heparina durante 15 minutos sin sustratos oxidativos. Las letras indican diferencias significativas entre los tratamientos (P<0,05).
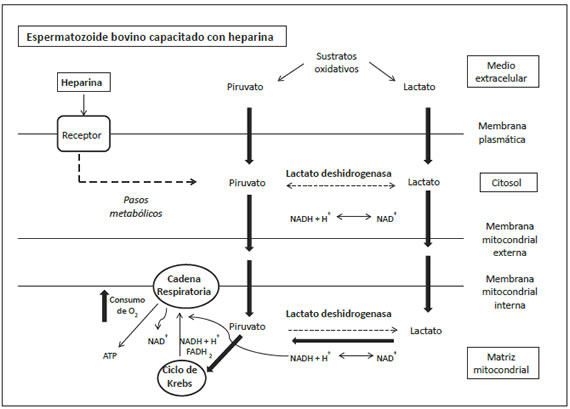
Esquema metabólico para la combinatoria piruvato/lactato en la capacitación con heparina del espermatozoide bovino. Las flechas negras señalan el camino de los esqueletos carbonados de piruvato y lactato en espermatozoides capacitados con heparina, llegando la estructura carbonada bajo la forma de piruvato a la vía metabólica del Ciclo de Krebs, cuyas coenzimas reducidas NADH+H+ y FADH2 ingresarán a la cadena respiratoria provocando un aumento del consumo de oxígeno celular.
Discusión
Considerando que los espermatozoides maduros son transcripcionalmente quiescentes, pierden la capacidad de expresar proteínas y de transportar vesículas25. Debido a la alta condensación de la cromatina nuclear y a la pérdida de citoplasma y de organelas, la célula espermática no es capaz de sintetizar RNA de novo y el mRNA no se traduce a proteínas. De esta manera, los espermatozoides no sintetizan nuevos compuestos y por tanto deberán llegar al ovocito con lo producido durante la espermatogénesis. Es por ello que resulta un desafío para el espermatozoide modular su requerimiento energético sin aumentar la síntesis de enzimas, como un fenómeno metabólico adaptativo tal como ocurre en las células somáticas. Los espermatozoides poseen las enzimas necesarias para llevar a cabo vías metabólicas como la glucólisis, el ciclo de Krebs, la oxidación de ácidos grasos y la cadena respiratoria17, siendo más dependiente de determinados sustratos que se adaptan a las vías metabólicas disponibles, principalmente aquellas que ocurren dentro de las mitocondrias que proveen la energía necesaria para la motilidad2,17.
Los hallazgos del presente estudio indican que en espermatozoides capacitados con heparina, tanto el piruvato como el lactato son requeridos para permitir la capacitación, debido a que ambas estructuras carbonadas mencionadas serían necesarias para su translocación a través de la membrana mitocondrial interna y su oxidación a través de la cadena respiratoria provocando de esta manera el burst respiratorio. Se ha reportado que el lactato y el piruvato pueden ingresar y salir de la célula espermática a través de dos tipos diferentes de transportadores de monocarboxilatos (MCTs), encontrados en las membranas citoplasmáticas y mitocondriales del espermatozoide. Entre estos transportadores se han identificado el MCT1, localizado en la cabeza espermática pero que desaparece con la maduración, y el MCT2, que se localiza en la cola y que nunca desaparece, siendo este último transportador el involucrado principalmente en la lanzadera de LDH16. Además, se han encontrado evidencias de que la entrada y salida de lactato y piruvato a la mitocondria estaría mediada por un sistema de transporte lactatopiruvato o translocasa9,24.
En espermatozoides capacitados con heparina, la disminución del lactato en el medio de incubación confirmaría que los esqueletos carbonados de los sustratos son derivados a su oxidación mitocondrial. En espermatozoides bovinos criopreservados, el camino metabólico oxidativo que desencadena la heparina en su inducción de la capacitación, estaría indicando que el piruvato sería metabolizado a través del ciclo de Krebs (Esquema Metabólico) en forma similar a lo observado en el espermatozoide de epidídimo de ratón31.
Nuestros datos sugieren que el piruvato y lactato favorecen la entrada a la gameta debido a que las traslocasas necesitan de los esqueletos carbonados en forma de lactato y piruvato, y de allí su destino metabólico sería el de proveer energía como se confirma por la ausencia de capacitación con el agregado de una doble concentración de piruvato. En el medio intracelular la actividad de lactato deshidrogenasa favorece el destino oxidativo metabólico y el mantenimiento del estado redox requerido para la capacitación con heparina9.
El lactato in vivo está presente en el fluido seminal y en las secreciones del tracto genital femenino en altas concentraciones, y puede ser utilizado como metabolito oxidativo por el espermatozoide humano23 y el bovino2. Las gametas femeninas también requieren de esta dinámica de sustratos oxidativos para obtener la energía necesaria para sus procesos intracelulares. Es así como en los complejos ovocito-cumulus de bovino, el lactato y piruvato, que pasan del cumulus al ovocito a través de las uniones gap presentes entre células del cumulus y entre el cumulus y el ovocito, son utilizados por el ovocito para la obtención de energía5,13. El lactato en el ovocito se reoxida a piruvato por acción de la enzima lactato deshidrogenasa, mientras que el piruvato tiene dos destinos posibles, ingresar a la mitocondria para su oxidación total a través del Ciclo de Krebs y la cadena respiratoria6.
La ausencia de sustratos oxidativos inhibe la capacitación espermática y sólo un 40% de la población permanece viva sugiriendo que existen sustratos oxidativos endógenos que permitirían mantener un metabolismo basal. El descenso de lactato se vincula con el aumento de consumo de oxígeno. En presencia de piruvato o piruvato/ lactato, el destino metabólico del piruvato sería el ingreso a una vía oxidativa como el ciclo de Krebs, como lo demuestra la baja producción de lactato y el aumento de consumo de oxígeno, acordando este hallazgo con la disminución de la actividad de lactato deshidrogenasa en espermatozoides bovinos capacitados con heparina, resulta en un uso más eficiente del piruvato para obtener energía a través del ciclo de Krebs9.
La función mitocondrial es un punto clave en la obtención de energía en el espermatozoide bovino capacitado con heparina. Nuestro estudio sugiere que en espermatozoides con mitocondrias acopladas la combinación que mantiene la carga energética favoreciendo una respiración celular es la de piruvato y lactato. Aunque la criopreservación altera la membrana plasmática y la integridad mitocondrial26 necesarias para la función espermática, se demuestra en este trabajo que las mitocondrias retienen la capacidad de preservar el acoplamiento respiratorio requerido para la síntesis de ATP. En el espermatozoide bovino, la presencia de heparina incrementa la frecuencia del batido flagelar e induce un incremento significativo en la amplitud del desplazamiento lateral de la cabeza, comparado con los espermatozoides incubados sin heparina7. Los cambios espermáticos asociados con la capacitación incluyen un incremento en la motilidad espermática33 y en el consumo de oxígeno18. En el presente estudio, nosotros inferimos que el estado energético espermático generado por la heparina se corresponde con una respiración mitocondrial activa y un consumo de oxígeno incrementado, sólo en presencia de lactato y piruvato.
De la capacitación máxima obtenida con heparina en presencia de diferentes sustratos oxidativos, se infiere que es la combinación de piruvato/lactato la mejor opción para mantener la más alta viabilidad espermática, un burst respiratorio celular y un alto porcentaje de espermatozoides capacitados, asegurando un metabolismo activo de la gameta para cubrir los requerimientos energéticos del proceso espermático. Este estudio contribuye a optimizar las condiciones del espermatozoide criopreservado bovino que aseguren la fertilización en el marco de las biotecnologías aplicadas a la producción bovina.
Agradecimientos: Esta investigación fue financiada por la Universidad de Buenos Aires. Los autores agradecen a Genética Los Nogales por la provisión de las muestras y a Astra por el agua bidestilada.
1. Alm, H., Torner H.; Blottner, S.; Nürnberg, G.; Kanitz, W. effect of sperm cryopreservation and treatment with calcium ionophore or heparin on in vitro fertilization of horse oocytes. Theriogenology 2001; 56: 817-829. [ Links ]
2. Beconi, M.T.; Beorlegui, N.B.; Sarmiento, N.K.; Mora, N.G. Phosphorylant capacity study and lactate mitochondrial oxidation in frozen bovine sperm. Life Sci 1990; 47(6): 477-483. [ Links ]
3. Breitbart, H.; Naor, Z. protein kinases in mammalian sperm capacitation and the acrosome reaction. Rev Reprod 1999; 4: 151-159. [ Links ]
4. Beorlegui, N.B.; Cetica, P.D.; Trinchero, G.; Córdoba, M.; Beconi, M.T. Comparative study of functional and biochemical parameters in frozen bovine sperm. Andrologia 1997; 29: 37-42. [ Links ]
5. Cetica, P.; Pintos, L.; Dalvit, G.; Beconi, M. Activity of key enzymes involved in glucose triglyceride catabolism during bovine oocyte maduration in vitro. Reproduction 2002; 124: 675-681. [ Links ]
6. Cetica, P.; Pintos, L.; Dalvit, G.; Beconi M. Involvement of enzymes of amino acid metabolism and tricarboxylic acid cycle in bovine oocyte maduration in vitro. Reproduction 2003; 126: 753-763. [ Links ]
7. Chamberland A.; Fournier, V.; Tardif, S.; Sirard, M.; Sullivan, R.; Bailey, J. The effect of heparin on motility parameters and protein phosphorylation during bovine sperm capacitation. Theriogenology 2001; 55: 823-835. [ Links ]
8. Córdoba, M.; Mora, N.; Beconi M.T. Respiratory burst and NAD(P)H oxidase activity are involved in capacitation of cryopreserved bovine spermatozoa. Theriogenology 2006; 65: 882-892. [ Links ]
9. Córdoba, M.; Pintos, L.; Beconi M.T. Heparin and quercitin generate differential metabolic pathways that involve aminotransferases and LDH-X dehydrogenase in cryopreserved bovine spermatozoa. Theriogenology 2007; 67: 648-654. [ Links ]
10. Córdoba, M.; Santa Coloma, T.; Beorlegui, N.; Beconi, M. Intracellular calcium variation in heparincapacitated bovine sperm. Biochem Mol Biol Int 1997; 41(4): 725-733. [ Links ]
11. Dalvit, G.C.; Miragaya, M.H.; Chaves, M.G.; Beconi, M.T. Energy requirement of bovine spermatozoa for in vitro capacitation. Theriogenology 1995; 44(7): 1051-1058. [ Links ]
12. Dapino, D.J.; Marini, P.E.; Cabada, M.O. Effect of heparin on in vitro capacitation of boar sperm. Boil Res 2006; 39: 631-639. [ Links ]
13. Dumollard, R.; Duchen, M.; Carroll, J. The role of mitochondrial function in the oocyte and embryo. Curr Top Dev Biol 2007; 77: 21-49. [ Links ]
14. Fukui, Y.; Sonoyama, T.; Mochizuki, H.; Ono, H. Effects of heparin dosage and sperm capacitation time on in vitro fertilization and cleavage of bovine oocytes matured in vitro. Theriogenology 1990; 34(3): 579-591. [ Links ]
15. Garrett, L.J.; Revell, S.G.; Leese, H.J. Adenosine triphosphate production by bovine spermatozoa and its relationship to semen fertilizing ability. J Androl 2008; 29: 449-458. [ Links ]
16. Gladden, L.B. Lactate metabolism: a new paradigm for the third millennium. J Physiol 2004; 558-1: 5-30. [ Links ]
17. Hafez, E.S.E.; Hafez, B. Reproducción e inseminación artificial en animales. McGraw-Hill Interamericana Editores, México, 2002. [ Links ]
18. Hammer, S.E.; Williams, W.L. Effect of female reproductive tract on sperm metabolism in the rabbits and fowl. J Reprod Fertil 1963; 5: 143–150.
19. Hereng, T.H.; Elgstoen, K.B., Cederkvist, F.H.; et al. Exogenous pyruvate accelerates glycolysis and promotes capacitation in human spermatozoa. Hum Reprod 2011; 26(12): 3249-3263. [ Links ]
20. Jackson, D.C.; Wang, T.; Koldkjaer, P.; Taylor, E.W. Lactate sequestration in the carapace of the crayfish Autropotamobius pallipes during exposure in air. J Exp Biol 2001; 204: 941-946. [ Links ]
21. Kamp, G.; Busselmann, G.; Lauterwein, J. Spermatozoa: models for studying regulatory aspectos of energy metabolism. Experentia 1996; 52(5): 487-494. [ Links ]
22. Lee, C.N.; Ax, R.L. Concentrations and composition of glycosaminoglycans in the female bovine reproductive tract. J Dairy Science 1984; 67: 2006- 2009. [ Links ]
23. Mann, T. The biochemistry of semen and of the male reproductive tract. John Wiley and Sons. New York, USA, 1964: 27-96. [ Links ]
24. Milkowski, A.; Lardy, H. Factors affecting the redox state of bovine epididymal spermatozoa. Arch of Biochem and Biophys 1977; 181(1): 270-277. [ Links ]
25. Miller, D.; Ostermeier, G.C. Towards a better understanding of RNA carriage by ejaculate spermatozoa. Hum Reprod Update 2006; 12(6):757- 67. [ Links ]
26. O´Connell, M.O.; McClure, N.; Lewis, S.E.M. The effects of cryopreservation on sperm morphology, motility and mitochondrial function. Hum Reprod 2002; 17(3): 704-709. [ Links ]
27. Parrish, J.J. Bovine in vitro fertilization: In vitro oocyte maduration and sperm capacitation with heparin. Theriogenology 2014; 81: 67-73. [ Links ]
28. Parrish, J.J.; Susko-Parrish, J.L.; Handrow, R.; First, N. Effect of sulfated glycoconjugates on capacitation and the acrosome reaction of bovine in hamster spermatozoa. Gamete 1989; 24: 403-413 [ Links ]
29. Parrish, J.J.; Susko-Parrish, J.L.; Winer, M.A.; First, N.L. Capacitation of bovine sperm by heparin. Biol Reprod 1988; 38: 1171-1180. [ Links ]
30. Putney, J.W.; Bird, G.S.J. Calcium mobilization by inositol phosphates and intracellular messenger. Trends Endocrinol Metab 1994; 5: 256-260. [ Links ]
31. Van Dop, C.; Hutson, S.; Lardy, H. Pyruvate metabolism in bovine epididymal spermatozoa. J Biol Chem 1977; 252(4): 1303-1308. [ Links ]
32. Yanagimachi, R. Mammalian fertilization, chapter 5. En Knobil E, Neill J.D. (eds). The physiology of Reproduction. Raven press, Ltd. New York, USA, 1994: 189-317. [ Links ]
33. Yanagimachi, R. The movement of golden hamster spermatozoa before and after capacitation. J Reprod Fertil 1970; 23: 193–196.














