Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
RIA. Revista de investigaciones agropecuarias
versión On-line ISSN 1669-2314
RIA. Rev. investig. agropecu. vol.43 no.1 Ciudad Autónoma de Buenos Aires abr. 2017
ARTÍCULOS
Vegetación espontánea en el cinturón hortícola platense hospedante de Thripidae (Thysanoptera) vectores de Tospovirus
Carrizo, P.I.1; Amela García, M.T.2, 3
1Universidad de Buenos Aires, Facultad de Agronomía. Depto. de Producción Vegetal. Cátedra de Zoología Agrícola. Buenos Aires, Argentina. Correo electrónico: pcarrizo@agro.uba.ar
2Universidad de Buenos Aires, Facultad de Ciencias Exactas y Naturales. Depto. de Biodiversidad y Biología Experimental. Buenos Aires, Argentina.
3CONICET, Universidad de Buenos Aires. Instituto de Micología y Botánica (INMIBO). Buenos Aires, Argentina.
Recibido 13 de agosto de 2015
Aceptado 01 de noviembre de 2016
Publicado online 05 de abril de 2017
RESUMEN
El virus de la peste negra (TSWV) es un Bunyaviridae que causa diferentes síntomas a las plantas, incluso la muerte. En Argentina existen 4 especies de tisanópteros transmisoras: Frankliniella occidentalis, Frankliniella schultzei, Frankliniella gemina y Thrips tabaci. El objetivo del estudio fue conocer las plantas de la vegetación espontánea circundante a los invernaderos de pimiento que actúan como hospedantes verdaderas (de reproducción) de los trips vectores mediante identificación de adultos y de larvas. El estudio se llevó a cabo en tres sitios ubicados en el cinturón hortícola platense (Buenos Aires, Argentina). Durante los años 2000 a 2003 se realizaron relevamientos mensuales en las áreas de los establecimientos en donde no se lleva a cabo el control de las malezas, extrayendo flores de la vegetación espontánea. A través de 60 fechas de muestreo se recolectaron y procesaron 14.636 flores de la vegetación espontánea de las cuales se obtuvieron 54.050 individuos de Thysanoptera, 40.356 adultos (96,96% Thripidae y 3,04% Phlaeothripidae) y 13.694 larvas de primer y segundo estadio (94,1% Thripidae vs. 5,9% Aeolothripidae y Phlaeothripidae). Se registró la presencia de las cuatro especies de trips vectores en el área. La familia botánica no mostró relación con la presencia de trips vectores, ya sea como adulto o larva. De las 40 especies de la vegetación espontánea relevadas resultaron: 19 no hospedantes (NoH), 21 hospedantes de alimentación (HA), 18 hospedantes reproductivos (HR) tanto en sentido amplio (18 sp.) como en sentido estricto (11 sp.) para una, dos, tres o las cuatro especies.
Palabras clave: Frankliniella occidentalis; Frankliniella schultzei; Frankliniella gemina; Thrips tabaci; Hospedantes de alimentación; Hospedantes reproductivas.
ABSTRACT
The tomato spotted wilt virus (TSWV) is a Bunyaviridae that causes different symptoms to plants, even death. In Argentina, there are 4 thrips species reported as vectors of Tospovirus: Frankliniella occidentalis, Frankliniella schultzei, Frankliniella gemina and Thrips tabaci. The spontaneous vegetation growing within uncontrolled weedy areas near greenhouse peppers were identified as true reproductive hosts of thrips vectors, by means of adult and larval identification. Three sites were studied within the horticultural belt, a strip of 40 km around La Plata City (34°54’ lat. S, 57°55’ long. O), Argentina. During 2000-2003, monthly surveys were performed in the areas of the greenhouses were weed control does not take place, extracting flowers from the spontaneous vegetation. Through 60 sampling dates, 14,636 flowers of spontaneous vegetation were collected, and 54,050 Thysanoptera individuals were obtained, 40,356 were adults (96.96% Thripidae vs. 3.04% Phlaeothripidae) and 13,694 were larvae of 1st and 2nd stage (94.1% Thripidae and 5.9% Aeolothripidae and Phlaeothripidae). The four species seem to have very similar requirements, due the overlap respect to their feeding and breeding hosts. The botanical family was not related to the presence of thrips vectors, neither in adult or larval stage. Out of 40 surveyed weed species, 19 resulted non-host (NoH), 21 feeding host (HA), and the remnant 19, reproductive hosts (HR), (18 in wide sense and 11 in strict sense) for one, two, three or four species of thrips.
Keywords: Frankliniella occidentalis; Frankliniella schultzei; Frankliniella gemina; Thrips tabaci; Feed hosts; Reproductive hosts.
INTRODUCCIÓN
El virus de la peste negra (o Tomato spotted wilt virus TSWV) es un Bunyaviridae que ocasiona síntomas diferentes a las plantas como marchitez, manchas de diverso tipo, alteraciones en el crecimiento e incluso la muerte. Los Tospovirus son los únicos transmitidos por trips, los cuales lo adquieren a partir de una planta infectada durante los estadios larvales y lo transmiten durante su etapa adulta (Moritz et al., 2004). Entre las 14 especies reportadas como vectores, Frankliniella occidentalis (Pergande) es considerada la más peligrosa dado que es cosmopolita, y la más eficiente para la transmisión en la mayoría de los lugares testeados y para la mayor parte de los tospovirus (Riley et al., 2011). Desde el año 1995, cuando se registró una de las epidemias más severas de peste negra en la Argentina (Tomato Spotted Wilt Virus: TSWV) y luego de los primeros registros del trips F. occidentalis (De Santis, 1995; Dal Bó et al., 1995), el vector y el virus han provocado pérdidas económicas considerables en tomate, pimiento, lechuga, alcaucil, apio y varias especies ornamentales (Dal Bó, 2011). Solo cuatro vectores fueron hallados en nuestro país: F. occidentalis, Frankliniella schultzei (Trybom), Frankliniella gemina Bagnall y Thrips tabaci Lindemann (De Borbón et al., 2006); la primera es una plaga en la etapa reproductiva de los cultivos florihortícolas, y dominante en invernadero (Carrizo y Klasman, 2001; Carrizo y Benítez, 2002). Frankliniella occidentalis, en particular, ha sido detectada en estado adulto, aún en el invierno, en la provincia de Chubut (Rodríguez et al., 2012). Para el área hortícola platense, las condiciones térmicas durante la mayor parte del año (IdCyA 2014) serían adecuadas (Bergant y Trdan, 2006) tanto para el desarrollo como para la reproducción de, al menos, tres de las cuatro especies presentes.
Los trips vectores son capaces de sobrevivir dentro de las flores de la vegetación espontánea, desde donde migran hacia los cultivos. Aun cuando no produjeran descendencia en la vegetación espontánea, si los individuos que persisten en sus flores son portadores de virus, pueden infectar las plantas en almácigo o en postransplante durante la primavera temprana. Durante el período de desarrollo de los cultivos, la vegetación espontánea resulta un hábitat transitorio para los adultos que escaparon a los tratamientos químicos. Finalmente, cuando se produce la senescencia de los cultivos, estas actúan como un hábitat para los trips en el período de poscosecha (Cho et al., 1989). Si bien el control químico por calendario de los vectores constituye aún la estrategia de manejo más común, el productor bonaerense ha adoptado el uso de variedades de plantas resistentes y de medidas culturales, como la eliminación de plantas enfermas y el control de la vegetación espontánea. Sin embargo, esta última es llevada a cabo en franjas estrechas que rodean al cultivo y a los invernaderos, a través del corte periódico o en su defecto, por desflorado (Dal Bó, 2011). Por una parte, el virus TSWV y sus vectores son considerados polífagos ya que se han reportado más de 200 especies hospedantes en todo el mundo (Cho et al., 1989 y 1995; Chellemi et al., 1994; Cho et al., 1995, entre muchos otros). Sin embargo, su polifagia es aparente ya que la captura de una especie determinada de trips en una planta no es per se evidencia del carácter de hospedante. Por otra parte, si bien algunas asociaciones entre trips y plantas pueden considerarse alimentarias, no todas implican verdaderas relaciones de planta-trips, condición que requiere de la recolección repetida en esa planta, junto con la identificación de los adultos y de las larvas de las especies de trips recolectadas (Mound y Marullo, 1996).
Aunque debido a su importancia en el manejo de los tisanópteros plaga, el concepto de planta hospedante ha sido bastante discutido, aún no ha sido resuelto y es aplicado de forma ambigua (Mound, 2013). Asimismo, el término “breeding host” es traducido al español indistintamente como hospedante verdadero, reproductivo, o de cría; sin embargo tales términos no son equivalentes. El hospedante reproductivo se refiere a la generación de descendientes sin otra salvedad (o sensu lato) y solo por la presencia de larvas de la especie. Sin embargo, el hospedante de cría implica que la población puede, al menos, autosostenerse (o sensu stricto) lo cual es valorado mediante la proporción entre la densidad de larvas/adultos de la especie en esa planta (Northfield et al., 2008; Ripa et al., 2009). El impacto que la vegetación espontánea produce en la población de los vectores dependerá de su capacidad para refugiarlos y sustentar su desarrollo; por ende, la proliferación de aquellas que resultan hospedantes verdaderas, representa un riesgo para los cultivos. Tanto las hospedantes reproductivas y las de cría, como aquellas utilizadas como refugio o alimentación para los adultos pueden considerarse como fuentes potenciales para la migración de trips virulíferos hacia el cultivo. A fin de reducir las pérdidas producidas por la peste negra es necesario llevar a cabo un conjunto de medidas dirigidas al control de los hospedantes alternativos (Cho et al., 1989) dado que la eliminación de toda la vegetación es insostenible tanto desde el punto de vista económico como ambiental (Mound, 2013).
El objetivo del presente trabajo fue identificar las especies de vegetación espontánea que actúan como hospedantes para los Thripidae vectores de TSWV, en el agroecosistema hortícola del cinturón platense.
MATERIALES Y MÉTODOS
Área de estudio
Se seleccionaron tres sitios de muestreo dentro del cinturón hortícola del Gran La Plata (provincia de Buenos Aires, Argentina) que ocupa un radio de unos 40 km hacia el N, O y S de la ciudad de La Plata (34°54’ lat. S, 57°55’ long. O). Cada uno de estos sitios fue considerado como una unidad de experimento (UE):
- (GOR) Chacra Experimental Gorina, Ministerio de Asuntos Agrarios de la prov. de Buenos Aires; ubicada entre las calles 501 y 149 en el partido de La Plata. 34°54’36,10’’ lat.S, 58°02’13,05’’ long. O.
- (PER) Establecimiento comercial de producción de hortalizas; ubicado a 1 km de la estación Pereyra (Ferrocarril Roca) en el partido de Berazategui. 34°50’34,77’’ lat.S; 58°05’59,83’’ long. O. -
(OLM) Estación Experimental Julio Hirschorn, Facultad de Ciencias Agrarias y Forestales, Universidad Nacional de La Plata; ubicada en Avenida 66 entre 167 y 173 en el partido de los Hornos. 34°59’05,63’’ lat.S, 57°59’58,01’’ long. O. P
ara este estudio fue considerada el área sin control periódico de malezas: lugares incultos, bordes y caminos (dentro de los límites de cada UE o en su zona más inmediata de influencia). Las flores de distintas especies fueron tomadas al azar de los parches de vegetación, dado que los insectos tienden a distribuirse de forma agrupada. Las plantas correspondieron a 40 especies de dicotiledóneas (Cabrera y Zardini, 1978), para las cuales se contó con referencias previas respecto de la detección de Thripidae en sus flores (Carrizo, 1996 y 1998). No fueron consideradas las monocotiledóneas ya que en ellas la captura de trips vectores es rara u ocasional (De Borbón y Cardello, 2006). Las flores fueron cortadas por el pedicelo o pedúnculo y depositadas en bolsas de polietileno que se cerraron y conservaron en heladera hasta tres días posteriores a su recolección. Durante 1999 se realizaron muestreos cualitativos preliminares para definir la lista de especies vegetales para estudiar. Los criterios de selección fueron los siguientes:
a. que la especie de planta se encontrara en los tres sitios de muestreo;
b. que las poblaciones de las especies de plantas fueran abundantes (> 5);
c. que el número de trips recolectados en la muestra fuera >1.
Las plantas que cumplieron con estos tres criterios fueron muestreadas entre noviembre de 2000 y mayo de 2003, llevándose a cabo 1 a 3 muestreos por mes, de acuerdo a la estación del año (menor intensidad en otoño e invierno y mayor en primavera y verano). En todos los casos, la unidad de muestreo (u.d.m.) fue de 1 flor o inflorescencia según correspondiera, concretando 25 u.d.m./sp./fecha, tamaño muestral que resultó adecuado para detectar a las especies de trips de menor densidad relativa (Carrizo, 2002).
Los datos fueron expresados como densidad relativa por especie de trips, considerando el n.° de individuos de cada morfoespecie/n.° de muestras/especie de planta.
Procesamiento de las muestras
Las flores fueron sumergidas y agitadas en un recipiente de 15 cm de alto por 15 cm de diámetro que contenía etanol 60%, luego se volcó el contenido sobre un trozo de muselina ajustado a la boca de un frasco o vaso de donde fueron extraídos y colocados en una caja de Petri para luego proceder al recuento total de los individuos por estado de desarrollo (adulto o larva). Todo el material se conservó en frascos con alcohol 70% etiquetados.
Identificación de los tisanópteros
Los trips fueron agrupados preliminarmente en morfoespecies (morfotipos) y luego acondicionados en preparaciones microscópicas semipermanentes en líquido de Hoyer. Fueron identificados bajo el microscopio óptico Zeiss Axio Imager dotado de contraste diferencial por interferencia mediante claves para el estado adulto (De Borbon, 2009 y 2013; Nakahara, 1994; Mound y Marullo, 1996) y para el segundo estadio de larva (Speyer y Parr, 1941; De Borbon, 2007 y Kucharzcyk, 2010).
RESULTADOS
La lista completa de especies de plantas de la vegetación espontánea relevadas se detalla en la tabla 1; 19 de ellas no cumplieron con los criterios especificados en las recolecciones preliminares. Los resultados informados corresponden a los datos de captura de trips para las 21 especies de la vegetación espontánea restantes provenientes de 60 fechas de muestreo: 26 correspondieron al sitio GOR con 224 muestras, 18 a PER con 160 muestras y 16 a OLM con 127 muestras.
Tabla 1. Especies de plantas de la vegetación espontánea relevadas para el muestreo de trips en flores en el cinturón hortícola platense, 2000 - 2003.
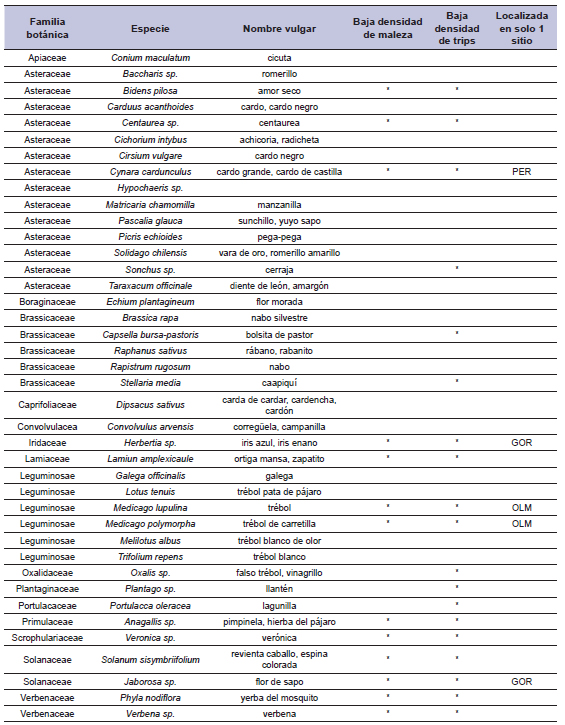
Referencias: GOR, PER, OLM. Sitios de estudio.
Fuente: elaboración propia.
En las 21 especies de la vegetación espontánea relevadas fueron recolectadas y procesadas 14.636 u.d.m. (flores de la vegetación espontánea), se extrajeron en total 54.050 ejemplares de Thysanoptera, de los cuales 40.356 individuos (74,66%) eran adultos (96,96% correspondieron a Thripidae y 3,04% a Phlaeothripidae) y los restantes 13.694 ejemplares (25,34%) eran larvas de primer y segundo estadio (94,1% correspondieron a Thripidae y 5,9% a Aeolothripidae y Phlaeothripidae). Los adultos de dos especies de Thripidae, Thrips trehernei Priesner y Tenothrips frici (Uzel) –ambas de color muy oscuro, casi negro– no pudieron distinguirse entre sí. Al no ser consideradas vectores (Riley et al., 2011), el número de cada una fue sumado e indicado en forma conjunta (tabla 2b).
Tabla 2a. Registro temporal de las capturas de trips en flores de la vegetación espontánea en el cinturón hortícola platense, 2000-2003.

Tabla 2b. Distribución temporal de las capturas de trips por especie y estado de desarrollo en el cinturón hortícola platense, 2000 - 2003.
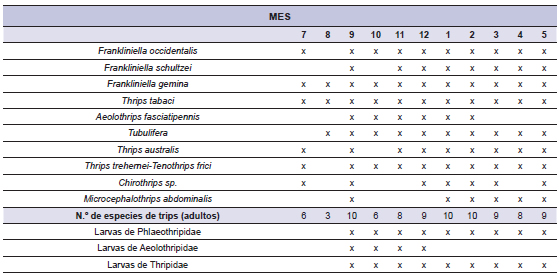
Fuente: elaboración propia.
De modo similar, para las larvas no fue posible establecer la correlación entre morfotipos y especies en los recuentos. Por ello, cada uno de los tres morfotipos larvales, en esta etapa se asignaron como: Phlaeothripidae (Tubulifera), Aeolothripidae (Terebrantia) y Thripidae (Terebrantia). Posteriormente, las larvas fueron identificadas hasta especie junto con la determinación de adultos, por especie de planta. En las tablas 2a y 2b se sintetizan la presencia y distribución temporal de las especies de la vegetación espontánea en flor y de los trips capturados en ellas por mes calendario, respectivamente. El número de taxones de plantas en flor por mes fue variable a través del año, los valores máximos (18-15 especies) se registraron entre noviembre y marzo y los mínimos (3-13 especies) entre abril y agosto (tabla 2a). Los trips adultos fueron capturados en todos los meses de muestreo mientras que las larvas fueron registradas entre septiembre y mayo (tabla 2b). Para los meses y fechas de muestreo en los cuales se registraron larvas de los trips vectores, en la tabla 3 se reflejó su rango de abundancia promedio en dos categorías, de modo que: (x) corresponde a una abundancia promedio (en cada evento de captura positiva) ≥1, y (+) corresponde a abundancia promedio (en cada evento de captura positiva) entre 0 y 1.
Tabla 3. Captura y abundancia de larvas de Thripidae en flores de la vegetación espontánea en el cinturón hortícola platense, 2000-2003.

Referencias: muestras con abundancia de larvas ≥ 1 (x) y 1 > larvas > 0 (+). Cada símbolo corresponde a la detección de larvas en ese mes y esa especie de planta.
Fuente: elaboración propia.
En las flores de todas las especies de la vegetación espontánea se halló a Frankliniella gemina, aunque en muy baja abundancia en Picris echioides y Echium plantagineum. De modo similar, Thrips tabaci fue hallada en todas las plantas, pero en mínima abundancia en P. echioides, Solidago chilensis, Taraxacum officinale, Baccharis sp. y Pascalia glauca. Respecto de F. occidentalis, fue hallada en general en muy baja abundancia en todas las plantas y no fue capturada en Baccharis sp. Por último, Frankliniella schultzei fue en general muy poco abundante y no se registró en Baccharis sp., E. plantagineum, Galega officinalis, Matricaria chamomilla ni Melilotus albus. Con respecto a los trips que no son vectores de la peste negra, se registraron ocasionalmente abundancias elevadas de adultos de Tenothrips frici - Thrips trehernei en P. echioides, Cichorium intybus, P. glauca, Hypochaeris sp, y T. officinale, mientras que en las demás plantas el registro fue nulo o esporádico. También fue esporádica la captura de Chirothrips sp. y del trips del eucalipto, Thrips australis. El pequeño trips de las compuestas Microcephalothrips abdominalis se encontró en muy baja abundancia y solo en cinco de las 10 especies de Asteraceae relevadas: Cirsium vulgare, M. chamomilla, S. chilensis, Baccharis sp. y P. glauca. El único trip predador correspondió a Aeolothrips fasciatipennis Blanchard, y fue hallado en una densidad relativamente alta solo en E. plantagineum, tanto en su etapa adulta como larval; en Conium maculatum, M. albus, M. chamomilla, Dipsacum sativus, T. officinale y Brassica rapa su captura fue esporádica y no fue registrado en las restantes plantas (figura 1).
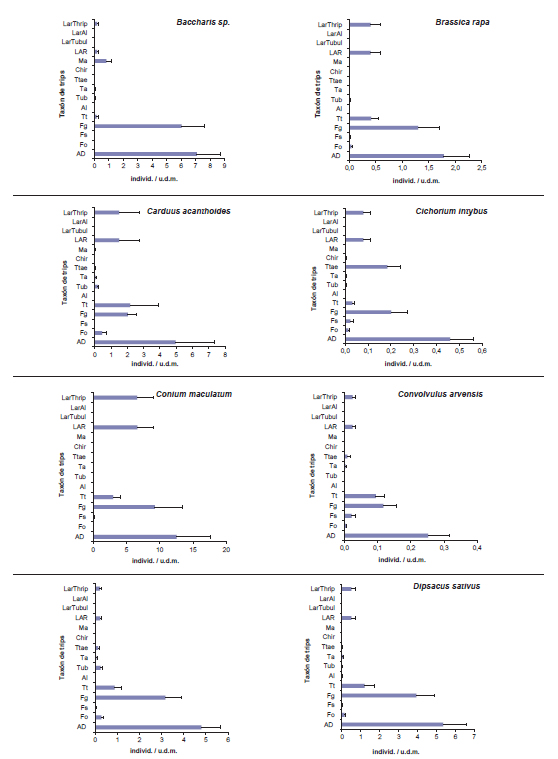

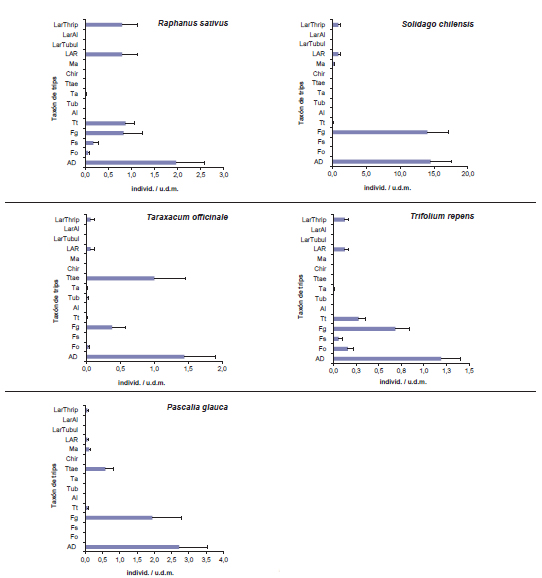
Figura 1. Abundancia promedio de adultos y larvas de trips por especie de planta en el cinturón hortícola platense, 2000-2003. Las barras representan el error estándar.
En la tabla 4 se resumen los diferentes estados para las especies de trips vectores (adultos y larvas) hallados en cada especie de planta. Los adultos de F. schultzei fueron capturados en 16 especies de plantas, los de F. occidentalis en todas excepto en Baccharis sp. (20 especies) mientras que los de F. gemina y T. tabaci fueron recolectados en 21 especies de plantas. Respecto de su detección en la etapa larval, F. gemina se halló en las flores de 16 plantas, T. tabaci en 11, F. occidentalis en siete y F. schultzei en seis. Larvas de los cuatro vectores en una misma planta solo se encontraron en tres de las 21 especies: E. plantaginaeum, M. chamomilla y Raphanus sativus. En las flores de tres plantas se hallaron tres especies de vectores mientras que en seis plantas se hallaron dos y solo en dos plantas fueron hallados uno o ninguno de los vectores. En la última columna de la tabla 4 se reflejó la proporción entre la abundancia de larvas/ adultos para los trips vectores. En esta se observa que 19 de las 21 especies de plantas relevadas pueden considerarse como hospedantes reproductivos sensu lato y de estas, 11 especies como hospedantes reproductivos sensu stricto.
Tabla 4. Síntesis del registro de adultos y larvas de Thripidae vectores en flores de la vegetación espontánea en el cinturón hortícola platense, 2000 – 2003.

Especies de trips vectores: Fo: Frankliniella occidentalis; Fg: Frankliniella gemina; Fs: Frankliniella schultzei; Tt: Thrips tabaci A: detección de adultos, L: detección de larvas L/A: Proporción: densidad promedio larvas/adultos; (-) no se hallaron larvas de los vectores
DISCUSIÓN Y CONCLUSIONES
Dado que la temperatura basal de desarrollo para Frankliniella occidentalis se sitúa alrededor de los 10 °C (Bergant y Trdan, 2006), se esperaría que hubiera escasa o nula actividad reproductiva entre mayo y octubre en los sitios de este estudio, ya que los registros históricos (1960- 2011) muestran una temperatura mínima media de 6-8 °C para mayo, junio y septiembre y de 4-6 °C para julio y agosto (IdCyA 2014). Sin embargo, si bien la reproducción (inferida por la presencia de larvas) se redujo en inviernoprimavera y de modo similar, en el otoño, las temperaturas máximas en primavera en el cinturón hortícola platense serían adecuadas para permitir la reproducción. En la estación experimental de la universidad de Florida, Paini et al. (2007) hallaron que aún para las plantas que presentaron un período de floración relativamente prolongado, la reproducción de los trips se concentró en la estación cálida y fue excepcional el hallazgo de larvas en el otoño; estas correspondieron a F. occidentalis y otros trips que no se hallan en Argentina, sobre flores de Solidago, Lagerstroemia y Ambrosia (Asteraceae). También Stewart et al. (1989) y Chellemi et al. (1994) encontraron hospedantes reproductivos durante casi todo el año en Florida.
Como en el presente trabajo, Ripa et al. (2009) hallaron larvas de F. occidentalis durante los meses de abril y mayo en el Valle de Aconcagua (Chile). De Borbón y Cardello (2006) registraron adultos de F. occidentalis y larvas de otros Thripidae durante agosto en la provincia de Mendoza. Cho et al. (1995) registraron larvas de Frankliniella spp. en Carolina del Norte, de las cuales solo las de F. occidentalis sobrevivieron hasta la primavera siguiente en la base de plantas de trigo. Mucho más al sur, en el valle de cultivo de cerezo de los alrededores de Gaiman en Chubut, Rodríguez et al. (2012) hallaron larvas de Thripidae y adultos de F. occidentalis en varias especies de la vegetación espontánea durante todo el invierno. Si bien las bajas temperaturas limitan el vuelo y la dispersión de los adultos, a latitudes tan altas como 50° lat. n en Columbia Británica (Canadá), los adultos pueden refugiarse durante el invierno en las flores de las plantas de bajo porte, como T. officinale (Pearsall 2000). Por lo tanto, las latitudes altas no serían limitantes para la supervivencia y reproducción de F. occidentalis, aun durante la época invernal. Al menos F. occidentalis no presenta diapausa obligada por la temperatura o la cantidad de horas de luz (Ishida et al., 2003). Por lo tanto, y tal como se desprende de los registros obtenidos para el área hortícola platense, los adultos vectores podrían sobrevivir al invierno aun en el exterior del invernadero, manteniendo su actividad alimentaria gracias a las especies de la vegetación espontánea que se hallan en flor, tales como Brassica rapa, Raphanus sativus, Rapistrum rugosum, Matricaria chamomilla, Taraxacum officinale y Trifolium repens. Al respecto, si bien los adultos durante el invierno-primavera se distribuyeron en las flores de varias especies, no fueron hallados en algunas típicas de ciclo invernal en el área, como Stellaria media y Capsella bursa-pastoris y otras especies de floración más tardía, como Sonchus sp., Bidens pilosa y Portulacca oleracea, registradas en otros países como hospedantes del virus.
La polifagia de las cuatro especies de trips vectores se demostró a través del registro de 16 plantas hospedadoras debido a la presencia de larvas de estas especies. La familia botánica de pertenencia no se relacionó con la presencia de los trips vectores, ya sea en estado adulto, larval o ambos. De modo similar, en Florida (Paini et al., 2007, Northfield et al., 2008, Baez et al., 2011) y en Chile (Ripa et al., 2009) no pudieron relacionar hospedantes reproductivos con patrones de endemismo o familia botánica. Por lo tanto, esta no podría utilizarse para predecir que determinada planta pueda actuar como hospedante verdadera. Sin embargo, Rodríguez et al., (2012) y De Borbón y Cardello (2006) consideran a Sisymbrium irio y Eruca sativa (ambas Brassicaceae) como hospedantes para F. occidentalis en Chubut y Mendoza, respectivamente. Incluso se hallaron algunas coincidencias a nivel de género o entre géneros cercanos. Al respecto, entre los hospedantes reproductivos de F. occidentalis y otras especies cogenéricas no presentes en el área platense (F. australis) o en nuestro país (F. tritici, F. bispinosa, F. fusca) se han considerado como hospedantes reproductivas a las mismas plantas halladas en este estudio u otras especies pertenecientes a los géneros Raphanus, Brassica o Solidago (Paini et al., 2007, Northfield et al., 2008; Ripa et al., 2009; Baez et al., 2011). Por lo tanto, de las 40 especies de plantas relevadas, 19 no resultaron hospedantes de alimentación. De las 21 especies restantes, todas serían hospedantes de alimentación para uno, dos, tres o los cuatro trips vectores y 14 plantas (todas menos Hypochaeris sp., P. echioides y C. intybus) serían hospedantes de reproducción sensu lato. Sin embargo, respecto de la consideración de una planta como hospedante reproductiva sensu stricto, solo 11 especies de plantas en las cuales la proporción entre la abundancia registrada para las larvas y adultos es ≥1 (última columna en la tabla 4), podrían sustentar poblaciones de, al menos, uno de los cuatro trips vectores presentes en el área platense. La mayor abundancia relativa de estos trips, reportada por diversos autores, en las flores de plantas perteneciente a los géneros Solidago, Brassica, Sysimbrium, Raphanus, Cardaria, Baccharis o Conium podría deberse al mayor tamaño de sus inflorescencias respecto del resto de las plantas. Los adultos utilizan las flores como refugio y sitio de apareamiento, prefiriendo flores que posean cavidades que brinden protección, por lo cual las inflorescencias densas los favorecen, aun en aquellas plantas en donde no se reproducen. Se esperaría por tanto, que una planta con mayor volumen individual posea más sitios y recursos alimenticios. Al respecto, Logarzo et al. (2012) concluyeron que para 26 especies de trips pertenecientes a dos subórdenes, 18 géneros y cuatro familias, incluyendo a F. occidentalis, el 80% de la variación en la abundancia en sus hospedantes puede explicarse por las diferencias en el volumen de las plantas. Al menos para F. occidentalis se demostró que es capaz de diferenciar formas (Mainali y Lim 2011), lo cual podría estar relacionado con la capacidad de distinguir tamaños (o volúmenes).
Por su parte, Pearsall (2000) demostró que la mayor abundancia de trips en una especie de planta respondía al tamaño individual de la inflorescencia y no a la densidad relativa de las plantas en el paisaje. Además F. occidentalis prefiere las flores de determinadas plantas en respuesta a señales químicas ya que es fuertemente atraída por las flores con mayor aroma. Existen varios estudios respecto de los compuestos involucrados en la preferencia de ovipostura de este trips (Mainali y Lim 2011 y otros allí citados). Si bien F. occidentalis es considerado generalista, las hembras no se orientan indistintamente hacia las plantas, sino que muestran una fuerte preferencia o repelencia, no solo frente a un hospedante preferido, sino aun en su ausencia (Cao et al., 2014). En las pruebas con seis hospedantes cultivados de estos autores, la relación entre la preferencia y el desempeño de la descendencia (desarrollo y supervivencia de los inmaduros) mostraron una correspondencia óptima. Otro factor para considerar es la respuesta de los trips respecto de las fases florales en cada flor individual, y el resultado de la sucesión de las fases en una inflorescencia de tamaño considerable, como Brassica, Raphanus, Raphistrum, Melilotus o Baccharis. Tanto los adultos de F. schultzei (Milne y Walter, 2000) como los de otras tres especies de Frankliniella (Alves-Silva et al., 2013) prefieren flores desde el inicio de la antesis, cuando no están completamente abiertas y aun cuando no tiene polen, como en el clavel cultivado (Carrizo y Klasman, 2001). Esa etapa de máxima atracción se presenta paulatinamente a través de cada una de las unidades que forman una inflorescencia. A su vez, esta apertura escalonada varía entre los ejemplares de la población y en períodos de floración de diversa duración dependiendo de cada especie de planta.
En conclusión, las 40 especies de plantas relevadas en el cinturón hortícola platense se clasificaron en una de las tres siguientes categorías: no hospedantes (NoH), hospedantes de alimentación (HA), hospedantes reproductivas (HR), ya sea sensu lato o sensu stricto, respecto de una, dos, tres o las cuatro especies de Thripidae vectores (tabla 5). La presencia de las verdaderas hospedantes reproductivas, no solo ofrece sitios de refugio y de alimentación durante todo el año y asegura la supervivencia de los trips hasta la siguiente temporada de siembra y las reinfestaciones durante la estación cálida, sino que también aseguran la reproducción de los trips vectores posteriormente a la finalización del cultivo.
Tabla 5. Conclusiones: listado de plantas y categoría como hospedantes de Thripidae vectores en el cinturón hortícola platense, 2000 a 2003.

Referencias: NoH: no hospedantes; HA: hospedante de alimentación; HR: hospedante reproductiva
Especies de trips vectores:Fo: Frankliniella occidentalis; Fg: Frankliniella gemina; Fs: Frankliniella schultzei; Tt: Thrips tabaci
AGRADECIMIENTOS
A Maria Elena Manna y Marisa Regonat del Departamento de Acarología y Entomología, Dirección de Laboratorio Vegetal (SENASA), por autorizar el uso del instrumental para la determinación en la fase larvaria. Este trabajo fue parcialmente financiado por los I.F.S. (Grantees, 5/2000) y G.W.I.S. (Vessa Notchev Fellowships, 7/2003).
BIBLIOGRAFÍA
1. ALVES-SILVA, E.; MARUYAMA, P.K.; CAVALLIERI, A.; DELCLARO, K. 2013. Flower stage and host plant preference by floral herbivore thrips (Insecta: Thysanoptera: Frankliniella) in a Brazilian savanna. Studies on Neotropical Fauna and Environment 48: 25-31. [ Links ]
2. BAEZ, I.; REITZ, S.R.; FUNDERBURK, J.E.; OLSON, S.M. 2011. Variation within and between Frankliniella thrips species in host plant utilization. J. Insect Sci. 11: 41. [ Links ]
3. BERGANT, K.; TRDAN, S. 2006. How reliable are thermal constants for insect development when estimated from laboratory experiments? Entomol. Experim. Appl. 120: 251-256. [ Links ]
4. CABRERA, A.L.; ZARDINI, E.M. 1978. Manual de la flora de la Provincia de Buenos Aires. Acme, Buenos Aires. [ Links ]
5. CAO, Y.; ZHI, J.; CONG, C.; MARGOLIES, D.C. 2014. Olfactory cues used in host selecion by Frankliniella occidentalis (Thysanoptera, Thripidae) in relation to host suitability. J. Insect Behav. 27: 41-56. [ Links ]
6. CARRIZO, P. 1996. Especies de trips (Insecta: Thysanoptera) presentes en flores de malezas en el área hortícola de La Plata (provincia de Buenos Aires, Argentina). Rev. Chilena de Entomología 23: 89-95. [ Links ]
7. CARRIZO, P. 1998. Hospederas naturales para trips vectores de peste negra: propuesta de calificación de riesgo. Bol. San. Veg., Plagas, España. 24 (1): 155-166. [ Links ]
8. CARRIZO, P.; KLASMAN, R. 2001. Infestación por Frankliniella occidentalis a través del proceso de apertura floral, en dos variedades de clavel para corte Dianthus cariophyllus. Bol. San. Veg., Plagas 27: 185-191. [ Links ]
9. CARRIZO, P.; BENITEZ, D. 2002. Frankliniella occidentalis. Captura con trampas adhesivas amarillas. Rev. Fac. Agr. Cuyo 35: 87-91. [ Links ]
10. CARRIZO, P. 2002. Establishing a weed host ranking for thrips vectors of tospovirus in La Plata horticultural belt of Buenos Aires, Argentina. Thrips and tospoviruses: Proceedings of the 7th International Symposium on Thysanoptera. Section VII: Control Strategies: 239-248. [ Links ]
11. CHELLEMI, D.; FUNDERBURK, J.; HALL, D. 1994. Seasonal abundance of flower-inhabiting Frankliniella species on wild plant species. Environ. Entomol. 23: 337-42. [ Links ]
12. CHO, J.J.; MAU, R.F.L.; GERMAN, T.L.; HARTMAN, R.W.; YUDIN, L.S.; GONSALVES, D.; PROVIDENTI, R. 1989. A multidisciplinary approach to management of tomato spotted wilt virus in Hawaii. Plant Dis. 73: 375-83. [ Links ]
13. CHO, K.; ECKEL, C.S.; WALGENBACH, J.F.; KENNEDY. 1995. Overwintering of thrips in North Carolina. Environmental entomology 24: 58-67. [ Links ]
14. DAL BÓ, E. 2011. Detección de virus transmitidos por trips: el caso particular de Argentina. Métodos en Ecología y Sistemática 6: 27-32. [ Links ]
15. DAL BÓ, E.; RONCO, L.; ALIPPI, A.; FERNÁNDEZ, R. 1995. TSWV on Chrysanthemum in Argentina. Plant Disease 79: 538. [ Links ]
16. DE BORBÓN, C.M. 2007. Clave para la identificación del segundo estadío larval de algunos trips comunes (Thysanoptera: Thripidae) en Mendoza, Argentina. Rev. FCA UN Cuyo 34: 69-81. [ Links ]
17. DE BORBÓN, C.M. 2009. Tres nuevas citas de trips (Thysanoptera: Thripidae) para la Argentina y clave de los géneros de la familia Thripidae presentes en el país Rev. FCA UN Cuyo. 36: 93-104. [ Links ]
18. DE BORBÓN, C.M. 2013. Especies del género Frankliniella (Thysanoptera: Thripidae) registradas en la Argentina, una actualización. Rev. FCA UN Cuyo 45: 259-284. [ Links ]
19. DE BORBÓN, C.M.; CARDELLO, F. 2006. Daños en brotes de duraznero asociado a trips y su relación con las malezas. RIA, 35 (3): 65-81. [ Links ]
20. DE BORBÓN, C.M.; GRACIA, O.; PICCOLO, R. 2006. Relationships between tospovirus incidence and thrips populations on tomato in Mendoza, Argentina. J. Phytopathology 15: 93-99. [ Links ]
21. DE SANTIS, L. 1995. La presencia en la República Argentina del trips californiano de las flores. Acad. Nac. Agr. y Vet. 49: 3-18. [ Links ]
22. INSTITUTO DE CLIMA Y AGUA, INTA. 2014. Isotermas. Registros históricos. Período 1960-2011. (Disponible: climayagua.inta.gov.ar/estadísticas_temperaturas_mínimas verificado 01 de octubre de 2013). [ Links ]
23. ISHIDA, H.; MURAI, T.; SONODA, S.; YOSHIDA, H.; IZUMI, Y.; TSUMUKI, H. 2003. Effects of temperature and photoperiod on development and oviposition of Frankliniella occidentalis (Pergande) (Thysanoptera: Thripidae). Appl. Entomol. Zool. 38: 65-68. [ Links ]
24. KUCHARZCZYK, H. 2010. Comparative morphology of the second larval instar of the Thrips species (Thysanoptera: Thripidae) occurring in Poland. Mantis publ. Co. Ed. A.S. Jadniszczak. Lublind, Polonia. [ Links ]
25. LOGARZO, G.; ZAMAR, M.I.; RICHMAN, D.; BRUZZONE, O. 2012. Structure and composition of a thrips community in the Chihuahua desert, New Mexico, U.S. Florida Entomologist 95: 35-42. [ Links ]
26. MAINALI, B.P.; LIM, U.T. 2011. Behavioral response of western flower thrips to visual and olfactory cues. J. Insect Behav. 24: 436-46. [ Links ]
27. MILNE, M.; WALTER, G.H. 2000. Feeding and breeding across host plants within a locality by the widespread thrips, Frankliniella schultzei. Divers. & Distrib. 6: 243-57. [ Links ]
28. MORITZ, G.; KUMM, S.; MOUND, L. 2004. Tospovirus transmission depends on thrips ontogeny. Virus Research 100: 143-149. [ Links ]
29. MOUND, L. 2013. Homologies and host-plant specificity: recurrent problems in the study of thrips. Florida Entomologist 96: 318-322. [ Links ]
30. MOUND, L.; MARULLO, R. 1996. The thrips of Central and South America. An Introduction (Insecta: Thysanoptera). Memoirs on Entomol., Internat. v6. Assoc. Publ. Fla. EUA. [ Links ]
31. NAKAHARA, S. 1994. The genus Thrips Linnaeus (Thysanoptera: Thripidae) of the New World. USDA Technical Bulletin N.o 1822. [ Links ]
32. NORTHFIELD, T.D.; PAINI, D.R.; FUNDERBURK, J.E.; REITZ, S.R. 2008. Annual cycles of Frankliniella spp. (Thysanoptera: Thripidae) thrips abundance on north Florida uncultivated reproductive hosts: Predicting possible sources of pest outbreaks. Ann. Entomol. Soc. Amer. 101: 769-778. [ Links ]
33. PAINI, D.R.; FUNDERBURK, J.E.; JACKSON, C.T.; REITZ, S.R. 2007. Reproduction of four thrips species (Thysanoptera: Thripidae) on uncultivated hosts. J. Entomol. Sci. 42: 610-615. [ Links ]
34. PEARSALL, I.A. 2000. Flower preference behaviour of western flower thrips in the Similkameen Valley, British Columbia, Canada. Entomol. Exper. et Appl. 95: 303-313. [ Links ]
35. RILEY, D.G.; JOSEPH, S.V.; SRINIVASAN, R.; DIFFIE, S. 2011. Thrips vectors of Tospoviruses J. Integ. Pest Manag. 1: 1-10. [ Links ]
36. RIPA, R.; FUNDERBURK, J.; RODRÍGUEZ, F.; ESPINOZA, F.; MOUND, L. 2009. Population abundance of Frankliniella occidentalis (Thysanoptera: Thripidae) anda natural enemies on plant hosts in Central Chile. Environ. Entomol. 38: 334-344. [ Links ]
37. RODRIGUEZ, J.; NEIRA, P.; CARRIZO, P. 2012. Variación estacional de los Thripidae en los montes de cerezo y la vegetación asociada al cultivo en el Valle Inferior del Río Chubut, Argentina. RIA 38: 46-54. [ Links ]
38. SPEYER, E.W.; PARR, J. 1941. The external structure of some thysanopterous larvae. Trans. R. Entomol. Soc. Lond. 91: 559-635. [ Links ]
39. STEWARTT, J.W.; COLE, C.; LUMMUS, P. 1989. Winter survey on Thrips (Thysanoptera: Thripidae) from certain suspected and confirmed hosts of tomato spotted wilt virus in South Texas. J. Entomol. Sci. 4: 392-401. [ Links ]














