Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista veterinaria
versión On-line ISSN 1669-6840
Rev. vet. vol.26 no.1 Corrientes jun. 2015
MISCELÁNEA
Obtención, evaluación y manipulación del semen de verraco en una unidad de producción mexicana
Córdova Izquierdo, A.1; Pérez Gutiérrez, J.F.2; Méndez Hernández, W.3; Villa Mancera, A.E.4; Huerta Crispín, R.4
1Departamento de Producción Agrícola y Animal, Universidad Autónoma Metropolitana, Unidad Xochimilco, México, DF; 2Facultad de Veterinaria, Universidad Complutense de Madrid, España; 3División de Ciencias Agropecuarias, Universidad Juárez Autónoma de Tabasco, México; 4Facultad de Veterinaria, Benemérita Universidad Autónoma de Puebla, México. E-mail: acordova@correo.xoc.uam.mx.
Resumen
Si bien la bibliografía veterinaria es fecunda en detalles técnicos sobre la manipulación seminal en bovinos, no ocurre lo mismo para la especie porcina. Se presenta una descripción de los aspectos más importantes del manejo del semen del verraco, con miras a maximizar su rendimiento reproductivo. Se detallan las técnicas y materiales necesarios para la obtención del semen, así como las pruebas para su correcta evaluación. Se describen los principales diluyentes, las tasas de dilución y los sistemas de conservación. Los métodos consignados han demostrado su eficiencia en varias unidades de producción porcina de México.
Palabras clave: cerdo, obtención de semen, conservación, evaluación, anomalías.
Collection, evaluation and handling routine of boar semen in a Mexican swine production unit.
Abstract
Although veterinary bibliography is rich in technical details about semen manipulation in bovines, the same does not happen for swine. A brief description of the most important aspects on the handling of boar semen to maximize the reproductive output is presented. Techniques and materials for semen collection as well as the tests for its correct evaluation are detailed. The main diluters, dilution rates and conservation systems are also described. These methods have demonstrated to be effective in several units of swine production in Mexico.
Key words: boar, semen collection, conservation, evaluation, anomalies.
Recibido: 2 diciembre 2014
Aceptado: 14 enero 2015
Introducción. El objetivo de esta comunicación fue presentar a la comunidad veterinaria las técnicas de obtención, manipulación, conservación, dilución y evaluación del semen de verraco, así como la adecuación del espermograma y el reporte de las principales anomalías detectadas. Se detalla la experiencia recogida a través del tiempo en varias unidades de producción porcina vinculadas a facultades de veterinaria de universidades mexicanas, en el convencimiento de que si bien el tema es muy conocido en el ganado bovino, está menos difundido para los porcinos. Las descripciones se iniciarán con las instalaciones necesarias para la obtención del semen.
El área de recolección. Potro. El local de recolección debe estar limpio y debe ser fácil de desinfectar9. También debe ser lo suficientemente amplia para brindar seguridad y confort para el operador, quien deberá trabajar de pie2, 8. El suelo debe lavarse diariamente (eliminando heces, semen y otros desechos). Semanalmente, la limpieza (Figura 1) debería incluir una desinfección de suelo, paredes, "potro" y otros materiales utilizados en las maniobras. El "potro" (Figura 2) debe ser sólido y estar fijo al suelo para poder resistir el peso del verraco y sus embates durante la fase de excitación; debe admitir la posibilidad de ajustar la altura y regular la inclinación para adaptarse al tipo de verraco. Debe admitir un fácil acceso del operador para manipular el prepucio y estar dotado de un recubrimiento que pueda ser higienizado pero que a la vez permita conservar el olor del verraco para su estimulación2, 8. La utilización de una alfombra en la parte trasera del potro puede evitar resbalones, permitiéndole al verraco un buen salto en el primer intento9.

Figura 1. Desinfección mediante "cañón de espuma"

Figura 2. "Potro" para la monta del verraco
Material para colectar el semen. Preferentemente, el eyaculado debe depositarse en vasos de cartón tapados con gasa médica (Figura 3) o filtro de papel. Los mejores resultados se obtienen con gasa doblada en varios grosores (x4, x8) y ajustada al vaso con una banda elástica2, 8. También puede usarse bolsitas plásticas desechables o vasos de precipitado (de vidrio), aunque estos últimos requieren ser previamente esterilizados. Sean cuales fueren los envases elegidos, antes de la recolección deberán ser colocados dentro de un termo calibrado a 30ºC2, 9.
Para evitar el choque térmico del semen, debe disponerse de un termo identificado con los datos del verraco. El termo debe limpiarse tras cada recolecta y antes de utilizarlo debe precalentarse en un ambiente estanco a 38ºC (p.ej. un armario cercano al local de recolección, con aislamiento de telgopor, en el que se instala un foco conectado a un termostato fijado a 38ºC, configurando un área de almacenamiento tibia, seca y libre de polvo2, 9.
Todas las manipulaciones deberán ser efectuadas empleando guantes de polivinilo no empolvados. Evitar el uso de guantes de látex para cirugía (empolvados), ya que el polvo utilizado puede dañar a los espermatozoides. Una vez colocado los guantes y para evitar la contaminación, no se debe tocar al verraco, instrumental, instalaciones o cualquier otra cosa excepto el pene del cerdo9.

Figura 3. Vasos de cartón para colectar semen
Preparación del verraco. Dado que el prepucio constituye una potencial fuente de contaminación, es necesario higienizarlo y cortar los pelos más largos e higienizarlo. El masajeo que implica esta maniobra favorecerá la estimulación sexual. Se recomienda que esta labor sea realizada con guantes de polivinilo exentos de talco2, 8. Acto seguido se acondicionará el"potro" donde eyaculará el verraco, que usualmente no se resiste ni plantea ningún problema, especialmente si está entrenado. Es imperativo que el "potro" se encuentre bien ajustado y fijado al piso, caso contrario el animal puede fallar en su intento y resistirse a montas ulteriores. Resulta conveniente que los componentes de la "cabalgadura" emitan olores "estimulantes" para el cerdo, lo cual se consigue impregnando un paño con semen u orina de cerdas en celo9.
Obtención del semen. Para la técnica de recolección por mano enguantada los pasos a seguir son: asegurar que el recipiente (termo) esté identificado con el número del verraco; esperar que el pene sobresalga del prepucio mientras el verraco se excita sobre el potro; tomar el pene con la mano (sin apretar) para que el verraco se acostumbre al contacto; mantener el pene horizontalmente para evitar derrames sobre las manos, capaces de contaminar la colecta; excitar la extremidad del pene con los dedos pulgar o meñique; cuando el pene sobresalga del prepucio, apretar la extremidad del pene teniendo laprecaución de dejar sobrepasar la punta fuera de la mano (Figura 4)9. Al comienzo de la eyaculación se debe seguir apretando la extremidad del pene, aplicando presión discontinua para estimular la eyaculación. Desechar la primera parte del eyaculado (fracción pre-espermática: fluido claro, acuoso y con elevado recuento bacteriano). Recoger la fracción siguiente (fracción espermática, rica en espermatozoides, reconocible como un fluido blanquecino) en un vaso de cartón tapado con gasa. Esta porción contiene el 80-90% de todas las células espermáticas presentes en el eyaculado. La emisión deberá ser recolectada hasta que su aspecto cambie a un fluido más claro y acuoso (fracción post-espermática), el cual deberá ser desechado. Es necesario llegar siempre al final de la eyaculación, que dura de 5 a 20 minutos, y esperar la retractación del pene. Por último, pulverizar el pene y el prepucio con una solución de clorhexidina para desinfectarlos. El termo deberá ser colocado (dentro de los 15 minutos posteriores a la recolección del eyaculado), en una cámara o ambiente a 37°C.

Figura 4. Obtención del semen de verraco
Fracciones del eyaculado. Las primeras secreciones (10-15 ml) corresponden a la "fracción pre-espermática", un líquido procedente de las glándulas bulbouretrales o de Cowper, a menudo contaminado ya que es el primero en atravesar las vías genitales terminales. La "fracción espermática" es rica en espermatozoides y su volumen varía entre 50 y 150 ml, dependiendo de factores como estación del año, duración del día, temperatura exterior, medio ambiente social, nutrición, raza, edad y tamaño de los testículos. Es un fluido de color blanco lechoso, constituido principalmente por espermatozoides y secreciones de las vesículas seminales y próstata. La última fracción (post-espermática) es pobre en espermatozoides y su volumen puede alcanzar 200-300 ml. Procede esencialmente de la próstata y glándulas de Cowper. Es de color blanquecino transparente y presenta abundantes grumos. Durante la recolecta el semen puede llegar a aglutinarse, por lo que se propone la utilización de 80-100 ml de cualquier diluyente comercial para semen de cerdo precalentado a 37°C en el fondo del vaso o bolsa de recolecta2, 8, 9. Una vez recolectado, el semen deberá permanecer durante varios minutos en cámara estanca a 37°C. Durante todo el examen deberá ser mantenido a 35-37°C en baño maría1-3, 8.
Factores que afectan la calidad seminal. El estrés térmico es la primera causa de variación de la calidad del semen, en particular en zonas con clima continental, donde las variaciones térmicas pueden ser importantes. Una amplitud de 10°C junto a una temperatura ambiental máxima por encima de los 27°C tendrá repercusiones sobre la calidad del semen1, 3, 8. También deben tenerse en cuenta la raza y la edad. No todas las razas ostentan similares manifestaciones de libido ni análogos niveles cuali-cuantitativos de producción seminal. A veces, algún problema físico inherente a la raza es capaz de afectar la recolección de semen, como en los verracos de raza Pietrain, cuya conformación muscular puede limitar el salto sobre el potro, sobre todo al envejecer8, 9, 11. Otros factores que inciden negativamente son los ritmos de recolección demasiado frecuentes, el tipo de alimentación, la aparición de patologías y otros factores sobre los cuales aún no se conocen debidamente sus efectos, como el fotoperíodo (ritmo nictameral), aconsejándose lapsos de 12-14 h de luz natural, de ser necesario completados con luz artificial11, 12 .
Valoración de volumen y color. En primera instancia deberán estimarse las características macroscópicas del eyaculado. El volumen se determinará en una probeta o en las propias bolsas plásticas graduadas. Deberá observarse si el color es normal (blanco lechoso) o bien si aparecen otras tonalidades, indicativas de alteraciones patológicas del aparato reproductor o contaminaciones con orina durante la eyaculación8, 10, 11.
Motilidad. Para este examen microscópico se requiere utilizar una cantidad muy pequeña de semen, a efectos de evitar la formación de "capas" de espermatozoides en el portaobjetos. Luego de homogeneizar el eyaculado (manualmente o con un agitador de vidrio), se tomará una muestra con un tubo capilar o una micropipeta automática, o bien empleando la "técnica de las tres gotas"11, 12. Una vez depositada la muestra se tapará con un cubreobjeto y se colocará sobre la platina del microscopio, para evaluar los movimientos de los espermatozoides (a 200x)1, 2, 8.
La estimación de la motilidad espermática indicará la capacidad de movimiento de los espermatozoides, valorando la motilidad individual. Se trata de una evaluación cuali-cuantitativa que estima la tasa de espermatozoides en movimiento (de 0 a 100%) y la calidad (tipos) de motilidad (escala de 0 a 5)11, 12. Los espermatozoides inmóviles deberán considerarse "muertos". La tasa de espermatozoides vivos se calculará por diferencia entre la estimación inicial del número total de espermatozoides de un campo del microscopio, menos el número de espermatozoides inmóviles del mismo campo. Es aconsejable realizar esta maniobra en varios campos del microscopio. Debido a la dificultad de expresar numéricamente la cantidad de espermatozoides vivos, la valoración se expresa en porcentajes1, 2, 8, 12.
La calidad seminal puede expresarse en función del tipo de motilidad (desplazamiento) de los espermatozoides vivos, partiendo de la hipótesis que indica que cuanto más rápido y rectilíneo sea el desplazamiento mayor será su potencial fecundante. Existe una escala valorativa que consta de cinco categorías, 1: ligero temblor de los espermatozoides, 2: trayectos sinuosos con desplazamientos muy lentos, 3: trayectos sinuosos con desplazamiento bien visible, 4: 50% de trayectos rectilíneos con un desplazamiento muy rápido, y 5: 100% de los trayectos rectilíneos con desplazamientos muy rápidos1, 3, 8.
Además de estas técnicas de valoración subjetiva existen otros métodos más sofisticados apoyados en sensores eléctricos y técnicas fotoeléctricas computarizadas, que permiten obtener indicadores del movimiento espermático tales como velocidad, tipo de movimiento, trayectoria recorrida y desplazamiento angular, entre otros8, 9, 11. Sin embargo, estos sistemas tienen inconvenientes al ser utilizados con espermatozoides de verraco, debido a su alta variabilidad en función de la temperatura, actividad inhibitoria del plasma seminal y concentración espermática1, 3, 8.
Anomalías. Las principales son la presencia de impurezas en el semen y los fenómenos de aglutinación. Esta última es el acúmulo de espermatozoides (muertos o vivos), que pueden estar adheridos a células epiteliales o bien, unidos cabeza con cabeza. Este fenómeno (Figura 5) puede ser observado tanto en el eyaculado fresco, como en el semen diluido11, 12.
El grado de aglutinación suele medirse en una escala de 0 a 3. El grado 3 corresponde a más de un 30-40% de espermatozoides aglutinados. En algunas ocasiones, la presencia de aglutinación leve (de 0 a 2), desaparece al realizar la mezcla del eyaculado con el diluyente, merced a la estabilización química que proporciona este último, observándose posteriormente, una disminución del grado de aglutinación1, 3, 8. Entre las posibles causas de aglutinación pueden consignarse: presencia de restos de gel procedente de las glándulas bulbouretrales (filtrado defectuoso), concentración muy elevada de espermatozoides en el eyaculado, mala calidad espermática (espermatozoides muertos o con baja vitalidad), shock térmico por manipulación inadecuada del semen, contaminación bacteriana del eyaculado (bacterias resistentes a la gentamicina pueden provocar aglutinación en el semen), presencia de gran cantidad de células epiteliales o descamaciones y cambios en el pH del plasma seminal, generalmente asociados a procesos inflamatorios o disfunciones que afectan a las glándulas accesorias del verraco.
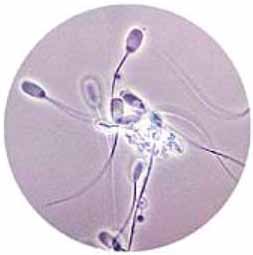
Figura 5. Espermatozoides aglutinados
Las gotas citoplásmicas son residuos del citoplasma normal de la fase de maduración epididimaria y se clasifican en dos grupos principales1, 2, 8. Las gotas proximales deben considerarse como verdaderas anomalías ya que se deben a una falla de maduración, la cual se asocia generalmente a la ausencia de poder fecundante. Las gotas distales (Figura 6) a menudo desaparecen algunas horas después de la recolección o durante la conservación en frío; se trata de un indicador a ser considerado "con indulgencia" ya que corresponde a una falta de maduración mucho más leve.
Los flagelos torcidos o enroscados sobre sí mismos (Figura 7) son anomalías importantes ya que los espermatozoides afectados no podrán desplazarse en el momento de la fecundación8, 9, 11.
Las anomalías del acrosoma son las más importantes para evaluar el poder fecundante, ya que de la integridad del acrosoma depende el reconocimiento por parte del ovocito y la penetración en la membrana pelúcida. La apreciación del acrosoma requiere de una amplia experiencia y de un examen en contraste de fases1, 3, 8.
Los límites permitidos para las diferentes anomalías son: un mínimo de 70% de espermatozoides vivos, motilidad con calificación mínima de 3 y un máximo de anomalías compuestas de gotas proximales y flagelos torcidos del 20%. Para la integridad acrosomal el porcentaje máximo de lesiones permitidas será también del 20%8, 9, 11.
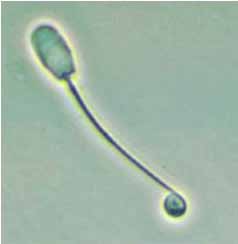
Figura 6. Gota citoplásmica distal
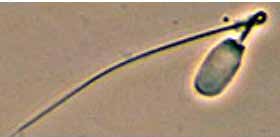
Figura 7. Flagelo enroscado sobre sí mismo
Recuento de espermatozoides. Permite determinar, para el total eyaculado, el número óptimo de dosis utilizables (con 3 mil millones de espermatozoides vivos). En nuestras unidades de producción porcina el método más utilizado es el recento en cámara. Para ello, 1 ml de semen se mezcla con 99 ml de solución de recuento (citrato de sodio 3,4% tratado con formol). Una gota de este preparado será depositado con una micropipeta, sobre la cámara de recuento. Se contaran únicamente las cabezas de los espermatozoides localizados en las cuatro cuadrículas que conforman las esquinas de la cámara, a partir del margen superior izquierdo, desplazándose hacia la derecha.
La concentración de espermatozoides se resolverá multiplicando: M x 400 x 10 x 200 x 10, teniendo en cuenta que M: media de espermatozoides contados, 400: superficie del cuadradito (1/400 mm2), 10: altura entre la cámara y el cubreobjetos (1/10 mm) [cifra que puede variar según el tipo de cámara], 200: factor de dilución, 10: conversión de mm3 a ml. Para obtener el número total de espermatozoides del eyaculado deberá multiplicarse la concentración/ml por la cantidad de ml colectados1-3, 8, 9-12.
Dilución del semen, diluyentes. Los diluyentes están concebidos para aumentar el volumen del eyaculado y preservar la viabilidad de los espermatozoides. Básicamente proveen una fuente adecuada de nutrientes, un ambiente que proteja a los espermatozoides contra la disminución de temperatura, electrolitos para mantener una adecuada presión osmótica, substancias buffer que protejan al semen contra cambios extremos de pH, y antibióticos que inhiban el crecimiento bacteriano5.
El plasma seminal por sí solo no asegura una conservación duradera del semen. Por lo tanto, para poder conservar los espermatozoides durante periodos prolongados es necesario que se reduzca la actividad metabólica de los espermatozoides, mediante la dilución en un medio adecuado y la reducción de la temperatura. Las peculiares particularidades que presenta el espermatozoide porcino hace que sea muy sensible al shock por frío, el cual genera una alteración de la viabilidad espermática debido a que cuando se reduce la temperatura los movimientos laterales de los fosfolípidos que componen la membrana se ven reducidos y se producen separaciones de fases lipídicas, desencadenando alteraciones irreversibles en las proteínas de las membranas2, 5.
Componentes de los diluyentes. Los diluyentes deben aportar los nutrientes necesarios para el mantenimiento metabólico de la célula espermática (glucosa), protegerla frente al shock térmico por frío (albúmina sérica bovina), controlar el pH del medio (bicarbonato, tri(hidroximetil)aminometano TRIS, ácido N-(2- hidroxietil)piperazin-N´-(2-etanosulfónico) HEPES), mantener la osmolaridad (NaCl, KCl) e inhibir el desarrollo microbiano (antibióticos)4, 6, 7.
El espermatozoide genera la energía necesaria para mantener su metabolismo celular y la motilidad del flagelo, principalmente a través de las vías glicolíticas. Estos procesos se desarrollan en las mitocondrias localizadas en la pieza intermedia del espermatozoide. La glucosa es la fuente de energía más frecuentemente utilizada en la composición de los diluyentes, aunque similares resultados se obtienen empleando galactosa, fructosa, ribosa o trehalosa. Por su parte, el pH del semen recién eyaculado se encuentra próximo a 7,4 y su disminución afecta el metabolismo energético y la motilidad del espermatozoide. La glicólisis desplegada por la célula espermática provoca la disminución del pH intracelular y la concomitante reducción del metabolismo celular, alteraciones que pueden ser controladas por medio de tampones (bicarbonato, citrato, TRIS, HEPES y otros)3, 4, 6, 7, 9.
El espermatozoide porcino ostenta una presión osmótica de 290-300 mOsm/l y es capaz de tolerar desde 240 hasta 380 mOsm/l. Los rangos entre 250 y 290 mOsm/l no afectan la viabilidad espermática, pero por debajo de 200 mOsm/l se produce una reducción significativa de la motilidad. Los diluyentes isotónicos (300 mOsm/l) compuestos por sales sódicas y potásicas son los más utilizados5. Con el fin de prevenir o retardar alteraciones en la estructura de las membranas de los espermatozoides, los diluyentes suelen incluir "estabilizadores de membrana" (seroalbúmina bovina BSA, hidroxi-tolueno butilado BTH, ácido etilen-diaminotetra- acético EDTA, polivinil pirrolidona PVP-40 y alcohol polivinílico3, 9.
Los antibacterianos contenidos en los diluyentes seminales actúan controlando la contaminación microbiana que se produce principalmente durante el proceso de la obtención del semen. El agregado de antibióticos frena la proliferación de gérmenes (E. coli, Salmonella sp., Pseudomonas sp. y otros) favorecida por la presencia de glucosa y por la temperatura de mantenimiento (15-16ºC). La contaminación bacteriana genera alteraciones como disminución de la motilidad, aglutinación espermática, alteraciones del acrosoma y reducción del pH hasta niveles ácidos (5,7 a 6,4), que conducen a una reducción del tiempo de conservación de las dosis seminales. La adición de penicilina y estreptomicina (1 g/l) fue en un principio la combinación más utilizada, posteriormente se emplearon con éxito aminoglicósidos como gentamicina, neomicina y kanamicina, en concentraciones próximas a los 200 mg/l2, 3, 5, 9.
La Oficina Internacional de Epizootias (OIE) aconseja que cuando los diluyentes contengan leche, yema de huevo u otras proteínas de origen animal, tales productos deberán estar libres de patógenos o esterilizados. Asimismo permite la adición de antibióticos siempre que sean declarados. Por su parte, la Unión Europea (UE, directiva 90/429) regula las normas aplicables a las importaciones de semen porcino postulando que se deberá utilizar una combinación de antibióticos eficaces contra leptospiras y micoplasma, cuya concentración deberá tener un efecto mínimo equivalente a 500 UI de estreptomicina, 500 UI de penicilina y 150 mg de lincomicina por ml4-7.
Tipos de diluyentes. Para semen de verraco, el diluyente base (de referencia) más difundido es el Beltsville Thawing Solution, conocido como "BTS". Contiene 37 g/l de glucosa (aporte energético), 6 g/l de citrato sódico y 1,25 g/l de EDTA (agentes quelantes estabilizadores de membranas), 1,25 g/l de bicarbonato sódico y 0,75 g/l de cloruro potásico (equilibrio iónico y pH), así como 0,60 g/l de penicilina y 1 g/l de dihidroestreptomicina (antibacterianos). Variantes de esta fórmula son los "diluyentes para conservación de corta duración" (1 a 3 días, útiles para ser preparados y utilizados en la misma granja) y "larga duración" (más de 4 días), que se utilizan cuando es más larga la distancia entre el lugar de producción seminal y el lugar donde va a ser utilizado el semen. Los diluyentes empleados en los procesos de congelación del semen porcino están basados en la utilización de yema de huevo y glicerol como agentes crioprotectores, una concentración elevada de azúcares (glucosa, fructosa) y la adición de un agente detergente3, 4, 6, 7, 9.
Para que los diluyentes cumplan su cometido deberá respetarse la tasa de dilución estipulada. El efecto tampón y la acción protectora de membranas sólo funcionarán con diluciones dentro del rango entre 1/10 y 1/25. Esta norma será tanto más importante cuanto más largo sea el período de conservación perseguido2, 5. Para evitar el shock térmico, el semen deberá verterse (lentamente) hacia el diluyente tras haber verificado que la temperatura de ambos fluidos sea compatible. Los tipos de almacenaje escogido (botellas flexibles, bolsas, equipos de inseminación que incluyan dosis y catéteres) deben limitar al máximo el contacto entre el aire y el semen (anaerobiosis)4, 6, 7.
Conservación del semen. El método de referencia para la conservación de semen de verraco a corto plazo, es la refrigeración progresiva por etapas, a temperaturas entre 15 y 17°C, con el cual se logran buenos resultados en fertilidad (mayores del 90%), al contrario de lo que acontece en otras especies (vacas, ovejas, cabras)8, 9, 11. La reducción de la temperatura debe hacerse en 2-3 h, hasta que el semen alcance la temperatura ideal para su conservación (15 a 17°C). La reducción de la temperatura inducirá disminución del metabolismo y la motilidad espermática, contribuyendo a frenar el crecimiento bacteriano2, 5. Temperaturas inferiores a 14°C provocan alteraciones de la membrana espermática y temperaturas superiores a 20°C no logran minimizar el metabolismo espermático ni detener el crecimiento bacteriano, circunstancias que disminuyen la vida útil del semen. Para la conservación a largo plazo (de 3 a 7 días) es aconsejable: escoger los mejores verracos (por examen del semen, acrosomas, resistencia osmótica u otros); verificar la compatibilidad del diluyente y del verraco (a veces algunos diluyentes no son los convenientes para algunos verracos); escoger un diluyente para larga conservación (que posea componentes capaces de controlar los residuos metabólicos y mantener la integridad de la membrana); aguardar un tiempo (una hora) para la adaptación del semen diluido a temperatura ambiente (20-22°C) antes de empezar la refrigeración; rotar 1-2 veces diarias las dosis para evitar los efectos nefastos de la sedimentación8, 9, 11.
1. Ashok A. 2006. Correlation of reactive oxygen species levels with the fertilization rate after in vitro fertilization: a qualified meta-analysis. Fertil Steril 84: 228-231. [ Links ]
2. Carmona MM. 2004. Crecimiento y finalización del cerdo. Tesis de Maestría, Universidad Nacional Autónoma de México, México, 347 p. [ Links ]
3. Carvajal G, Cuello C, Ruiz M, Vázquez MJ, Martínez AE, Roca J. 2004. Effects of centrifugation before freezing on boar sperm cryosurvival. J Androl 25: 389-396. [ Links ]
4. Cerolini S, Maldjian A, Pizzi F, Gliozzi TM. 2001. Changes in sperm quality and lipid composition during cryopreservation of boar semen. J Reprod Fertil 121: 395- 402. [ Links ]
5. Cremades T, Roca J, Rodríguez MH, Abaigar T, Vázquez JM, Martínez E. 2005. Kinematic changes during the cryopreservation of boar spermatozoa. J Androl 26: 610-618. [ Links ]
6. Gadea J, Marco MA. 2003. Los diluyentes de inseminación artificial porcina. Rev Investig Agríc 1: 17-27. [ Links ]
7. Gadea J, Sellés E, Marco MA, Coy P, Matás C, Romar R, Ruiz S. 2004. Decrease in glutathione content in boar sperm after cryopreservation. Theriogenology 62: 690- 701. [ Links ]
8. Gadea J. 2005. Sperm factors related to in vitro and in vivo porcine fertility. Theriogenology 63: 431-444. [ Links ]
9. Hazel LN. 2005. The science and practice of pig production. Tesis de Doctorado, Facultad de Medicina Veterinaria y Zootecnia, Universidad Nacional Autónoma de México, 292 pp. [ Links ]
10. Sancho S et al. 2007. Effects of cryopreservation on semen quality and the expression of sperm membrane hexose transporters in the spermatozoa of Iberian pigs. Reproduction 134: 111-121. [ Links ]
11. Sellés E, Gadea J, Romar R, Matas C, Ruiz S. 2003. Analysis of in vitro fertilizing capacity to evaluate the freezing procedures of boar semen and to predict the subsequent fertility. Reprod Domest Anim 38: 66-72. [ Links ]
12. Waterhouse KE, Hofmo PO, Tverdal A, Miller RR. 2006. Within and between breed differences in freezing tolerance and plasma membrane fatty acid composition of boar sperm. Reproduction 131: 887-894Links ] Helvetica, sans-serif">.














