INTRODUCCIÓN
El beneficio de implante percutáneo de la válvula aórtica (TAVI) por acceso femoral ha sido demostrado en diferentes estudios aleatorizados que incluyeron pacientes (pac.) de alto riesgo o inoperables,1,2 de riesgo intermedio 3,4 y de bajo riesgo. 5,6
De acuerdo con diferentes análisis, la presencia de regurgitaciones paravalvulares (RPV) leves se presenta entre el 20%- 40%, 7 y la de moderadas o graves en alrededor del 3% al 12%. 2 Estas últimas han sido asociadas con una mayor tasa de mortalidad. 8,9 Si bien su incidencia se ha visto reducida con la curva de aprendizaje de los operadores y los nuevos dispositivos, representa una complicación que debiera tratar de evitarse o resolverse en el momento del procedimiento.
Otro de los problemas que presentan las válvulas autoexpandibles es la necesidad del implante de un marcapaso definitivo (MCPD), con incidencia de alrededor del 17%-30% en los grandes estudios aleatorizados. 2-6
Para sobreponerse a esas limitaciones se ha desarro llado la técnica del implante alto de las válvulas aórticas percutáneas usando una vista de superposición de las cúspides derechas e izquierdas (Cusp Overlap, COVL) para disminuir el contacto con el septum membranoso y el sistema de conducción y con ello disminuir la necesidad de MCPD. 10
Esta estrategia ha demostrado en algunas series observacionales una disminución significativa de la necesidad de marcapaso definitivo (MCPD), 11-13 pero no se ha evaluado con claridad el impacto sobre la incidencia de filtraciones perivalvulares que produzcan una insuficiencia moderada o grave.
MATERIAL Y MÉTODOS
Se analizaron 206 pacientes consecutivos que recibieron TAVI con implante de válvulas autoexpandidles entre agosto de 2019 y mayo de 2022. Se utilizó una estrategia CON en los primeros 101 (49%), y COVL en los siguientes 105 (51%).
Fueron excluidos aquellos que presentaban una bioprótesis quirúrgica previa, implante previo de MCPD, válvula aórtica bicúspide, insuficiencia aórtica pura o predominante como indicación del TAVI o implante de una válvula expandible por balón.
El Punto Final Primario (PFP) fue definido como la presencia de RPV moderada o grave a 30 días, definidos según los criterios VARC 3. 14 Además, se analizó la ocurrencia de los siguientes eventos: muerte de cualquier causa, infarto agudo de miocardio (IAM), oclusión coronaria aguda debido al TAVI, Accidente Cerebro Vascular (ACV), sangrado mayor (definición del VARC), complicación vascular, cirugía cardíaca de urgencia, reintervención, necesidad de implante de MCPD y aparición de un nuevo bloqueo completo de rama izquierda (BCRI) persistente a 30 días.
Se definió Éxito del Implante (EI) al implante adecuado de la válvula con un gradiente residual menor a 10 mmHg al finalizar el procedimiento en ausencia de regurgitación grave, y Éxito Clínico (EC) al EI en ausencia de muerte, IAM, ACV, reintervención o cirugía valvular de urgencia.
Todos los pacientes. fueron evaluados por el “Heart Team Valvular” del Hospital, y se realizaron un eco-Doppler, una coronariografía con aortograma y una angiotomografía multicorte con reconstrucción 3-D con contraste intravenoso de la válvula aórtica, aorta torácica, aorta abdominal, arterias subclavias, ilíacas y femorales. A todos se les realizó un electrocardiograma (ECG) previo al TAVI, uno a las 24 horas y otro a los 30 días. El ecocardiograma Doppler color se realizó antes, inmediatamente después y a los 30 días.
Se utilizó sedación consciente como técnica anestésica, con excepción de aquellos en quienes no se usó el acceso femoral percutáneo, en los cuales se empleó anestesia general. Todos recibieron doble antiagregación con aspirina y clopidogrel, excepto aquellos que recibían anticoagulantes orales por alguna otra indicación, a los que solo se agregó, si no lo tomaban, el clopidogrel.
Durante el procedimiento recibieron anticoagulación con heparina 100U/Kg para el procedimiento, con los valores controlados durante el mismo.
En los que recibieron el implante con la estrategia CON, la válvula fue posicionada e implantada con empleo de la proyección coplanar de 3 cúspides de acuerdo con la angiotomografía y corregida por proyección angiográfica, usualmente en la proyección de oblicua anterior izquierda levemente craneal. El implante fue realizado con un objetivo de profundidad de implante de alrededor de 2-4 mm por debajo del anillo aórtico bajo estimulación a alta frecuencia (120 lat./min) con marcapaso transitorio, a discreción del operador.
En los que recibieron el implante con la estrategia de COVL se realizó un análisis previo detallado de la angiotomografía y allí se identificó la proyección en donde hubiera superposición de las cúspides derecha e izquierda en contraposición con la no coronariana, y se la eligió para la proyección en el implante. En caso de dificultades o diferencias se realizaron correcciones de acuerdo con la angiografía previa.
Cuando esto no fue posible se realizó el posicionamiento utilizando dos catéteres con curvas Pig-Tail o Amplatz AL2 ubicados en los senos derecho e izquierdo, y luego se buscó la proyección angiográfica que demostrara la superposición de las cúspides.
Usualmente la proyección de COVL coincide con una oblicua derecha con inclinación caudal.
El objetivo era el implante alrededor de 2-3 mm por debajo del anillo aórtico, con respecto al seno no coronariano.
Al momento de la liberación final, para lograr cierta esta bilidad del sistema, se utilizó también una sobreestimulación con marcapaso transitorio a 120 lat./min.
Tanto la predilatación, realizada con balón de menor diámetro que el anillo aórtico, como la posdilatación, fueron realizadas según el criterio del operador.
Todos los pac. fueron seguidos a 30 días. Se llevó a cabo consulta presencial y el análisis de la RPV fue realizado mediante eco-Doppler a 30 días del implante.
Consideraciones éticas
El estudio fue conducido de acuerdo con las normas de la Declaración de Helsinki y de acuerdo de las normas de la Conferencia Internacional de Buenas Prácticas Médicas; además todos los pac. firmaron un consentimiento del Hospital para realizar el procedimiento. Su identidad fue preservada para el momento del análisis.
Análisis estadístico
Las variables continuas son presentadas como promedio y desviación estándar, las variables categóricas son presentadas como valor absoluto y porcentaje. Se utilizó la prueba de Student para las variables continuas, Chi-cuadrado o Fisher para las categóricas. Se consideró significación estadística con p <0,05.
RESULTADOS
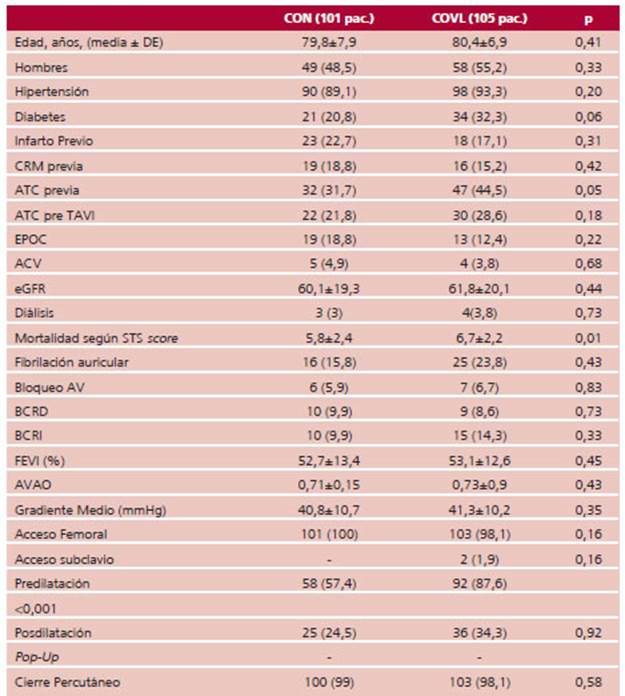
Las características clínicas de las poblaciones fueron similares; la edad fue de 79,8±7,9 vs 80,4±6,9 años en la estrategia CON vs COVL, fueron de sexo masculino el 48.5% vs. el 55%. No hubo diferencia en la prevalencia de hipertensión, infarto previo, cirugía coronaria previa, angioplastia coronaria (ATC) pre TAVI, enfermedad pulmonar obstructiva crónica (EPOC), función renal y diálisis. En el grupo COVL fue un poco más frecuente la presencia de diabetes (20,8% vs. 32,3% p = 0,06) y de ATC (31,7% vs. 44,8% p = 0,05).
La estratificación de riesgo de acuerdo con el STS score fue mayor en el grupo COVL (5,8 ± 2,4 vs. 6,9 ± 2,2 p=0,01).
En el ECG basal no hubo diferencia en la pre sencia de trastornos de conducción previos, tales como bloqueo aurículo ventricular (AV), bloqueo completo de rama derecha (BCRD), BCRI, o fibrilación auricular.
Tampoco hubo diferencia en la fracción de eyección del ventrículo izquierdo, gradiente transvalvular aórtico medio ni en el área valvular.
El acceso fue transfemoral en todos los pac., excepto en 2 del grupo COVL, en que se empleó acceso subclavio. La predilatación fue mayor en este grupo (87,6% vs. 57,4%, p <0,001) sin haber diferencia en uso de posdilatación. No hubo diferencia en la utilización del tipo de cierre vascular percutáneo; los dispositivos utilizados fueron PROSTAR XL® (ABBOTT Vascular, Santa Clara, California) y Proglide® (ABBOTT Vascu lar, Santa Clara, California. (Tabla 1)
Todas las válvulas implantadas fueron autoexpandibles. (Tabla 2)
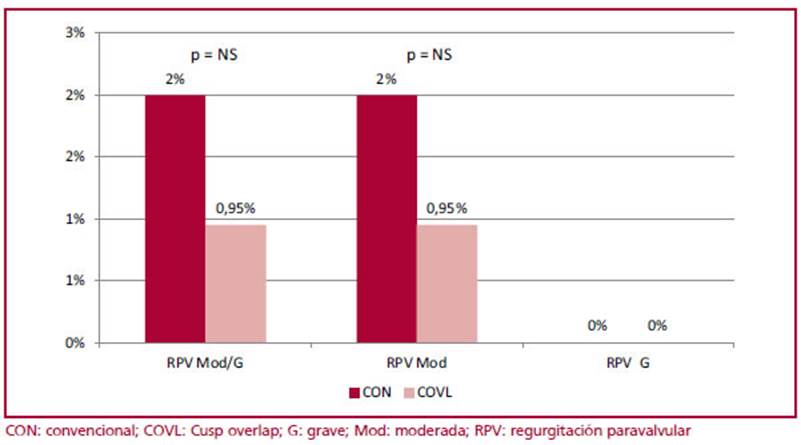
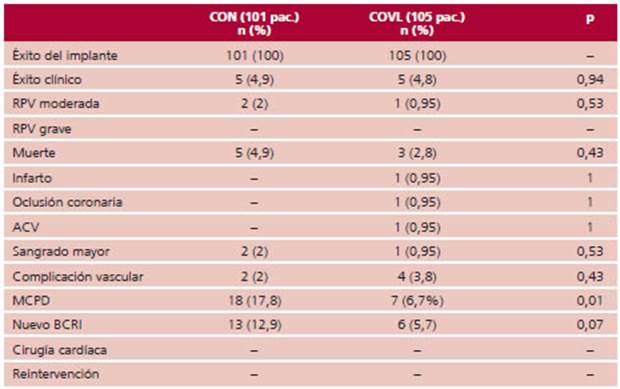
No hubo diferencia en el PFP a 30 días entre ambas estrategias (Figura 1), la RPV moderada fue de 2% para CON y de 0,9% para COVL, y ninguno presentó RPV grave. No hubo diferencia en mortalidad, IAM, oclusión coronaria, ACV, cirugía cardíaca, reintervención, en complicación vascular o sangrado mayor.
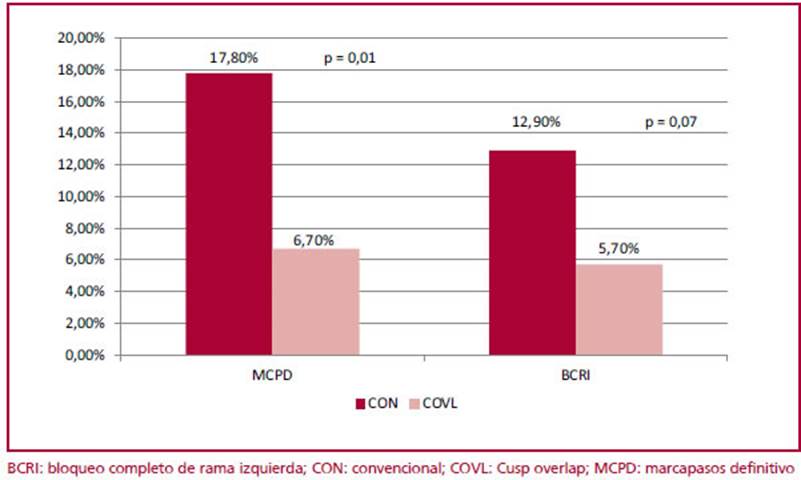
Con la estrategia de COVL hubo una reducción significativa de los trastornos de conducción luego del implante, con una menor necesidad de implante de MCPD: 6,7% vs. 17,8% (p = 0,01) y tendencia a menos aparición de nuevo BCRI: 5,7% vs. 12,9%, p = 0,07. De los que requirieron MCPD, 6 tenían ≥80 años y solo uno presentaba ritmo sinusal normal. Uno tenía fibrilación auricular previa, uno bloqueo AV de primer grado, dos BCRD, uno BCRI y uno bloqueo trifascicular. (Tabla 3) (Figura 2)
DISCUSIÓN
En nuestra serie, el TAVI con la técnica de COVL no se relacionó con una diferencia significativa en la presencia de RPV, comparado con la estrategia convencional, pero sí con menor necesidad de MCPD y menos BCRI sin haber diferencia en mortalidad, IAM, ACV, oclusión coronaria, complicaciones vasculares mayores y sangrado mayor, cirugía cardíaca o reintervención.
De los 7 pac. de nuestra serie que requirieron MCPD, 6 eran ≥80 años, y 5 tenían algún trastorno importante de conducción.
La presencia de RPV se ha relacionado con la calcificación valvular y su distribución, que generalmente es asimétrica, más importante en la valva y seno no coronariano en la mayoría de los pac. 15 En diferentes estudios se analizó la presencia de calcio y su volumen en la zona de implante 16,17 y se demostró que la asimetría de la calcificación se relaciona con RPV. 18 Además, algunos autores analizaron la presencia de calcio en el tracto de salida del ventrículo izquierdo. Este factor podría ser un predictor en la generación de RPV. Pero también debemos tener en cuenta que la calcificación del anillo puede favorecer su ruptura, especialmente en las válvulas expandibles por balón, en caso de predilataciones o posdilataciones agresivas y de la necesidad de una segunda válvula. 19-21
De acuerdo con el volumen de calcio en la zona de implante se podría predecir el grado de RPV: si es de 389 mm3 no habría RPV; si es de 371 mm3, leve; si es de 690 mm3, moderado, y con 777 mm3 grave. En la tomografía debemos analizar además la asimetría, ya que es un factor predictivo de RVP. 22
Respecto del género, las mujeres tienen menos riesgo de RPV moderadas o graves; esto parece estar relacionado con un anillo de menor diámetro que facilita el sellado perivalvular. 23
La presencia de regurgitación moderada a grave era algo más frecuente al comienzo de la experiencia, y con los dispositivos de primera generación. La curva de aprendizaje de los operadores, que ha permitido mejorar los implantes, y los nuevos dispositivos, que tienen una “pollera” perivalvular en la base para me jorar el sellado, han hecho que este fenómeno se haya reducido de manera muy significativa.
Si bien el uso de la técnica del COVL parece ayu dar en ese mismo sentido (de hecho en nuestra serie se ve reducido en un 50%), para obtener diferencias significativas se necesitarían cifras de pacientes muy superiores a nuestra experiencia.
La presencia de RPV moderadas o graves se asocia en numerosas ocasiones a disnea en baja clase funcio nal o incluso a hemólisis. Uno de los tratamientos propuestos, para evitar la cirugía, es el cierre de la RPV con plugs bajo control con eco-Doppler transesofágico. Esta estrategia, si bien no es sencilla de realizar y es utilizada con muy poca frecuencia, ha demostrado en algunas observaciones publicadas, tener una buena evolución, con una baja tasa de complicaciones. 24
En un importante metaanálisis se evaluó a 4 años la evolución de los pac. con RPV. 25 Aquellos con RPV moderadas a graves presentaron mayor mortalidad que los que tenían RPV leves o mínimas. Pero cuando se compararon las válvulas de primera generación con las de segunda, estas últimas presentaron significativamente menos RPV. También se comparó la evolución de las RPV mínimas vs. las leves; estas últimas presentaron una mortalidad mayor a 4 años. Es por este motivo que en la actualidad hay que ser muy precisos al momento del implante, elegir el dispositivo más conveniente y realizar posdilataciones, en caso de ser necesario, para tratar de dejar la menor regurgitación posible; idealmente, nula.
Nuestro grupo comenzó hace varios años con el implante de las válvulas autoexpandibles con la estra tegia COVL; en nuestras publicaciones demostramos una disminución significativa de la necesidad de MCPD luego del implante y una tendencia a menor BCRI sin aumento de las complicaciones ni de embolización de la válvula. En nuestras publicaciones los implantes fueron realizados con diferentes válvulas autoexpandibles en el grupo COVL. 11,12
Nosotros creemos que esta estrategia ofrece benefi cios, y si bien no observamos una diferencia significativa en la incidencia y gravedad de la RPV que tendría impacto en la sobrevida, la reducción de los trastornos de conducción post implante la justifican, ya que ellos también tienen impacto en la sobrevida y en los costos hospitalarios y a largo plazo. 26,27
Limitaciones
Las limitaciones de este análisis son que fue realizado un solo centro, la intervención no fue asignada aleato riamente. Se comparó una serie histórica de los últimos 101 pac. que fueron tratados con estrategia CON, para tratar de evitar que la curva de aprendizaje influyera, y los primeros 105 tratados con la estrategia de implante alto de la válvula aórtica percutánea.
CONCLUSIONES
En esta serie de un solo centro, la estrategia del im plante alto de la válvula aórtica percutánea no mostró diferencia en la presencia de RPV moderadas o graves, comparada con la estrategia convencional sin presentar diferencia en las complicaciones; y se asoció a una menor necesidad de marcapasos definitivos y a una tendencia a menos BCRI a 30 días.