INTRODUCCIÓN
En personas aparentemente sanas, el riesgo de un fu turo evento cardiovascular se relaciona con el número e intensidad de los factores de riesgo y la duración de la exposición. 1
Una estrategia ampliamente difundida en preven ción cardiovascular es identificar, mediante puntajes de riesgo, a aquellos individuos con un riesgo elevado de desarrollar enfermedad cardiovascular, y recomendar medidas preventivas según el nivel de riesgo calculado. 1,2 Los puntajes o funciones de riesgo son ecuaciones matemáticas que calculan la probabilidad de que un individuo presente el evento de interés en un determi nado intervalo de tiempo, según el nivel de exposición a diferentes factores de riesgo. 3 Sin embargo, estos puntajes tienen grandes limitaciones relacionadas con la calibración, la discriminación y la baja sensibilidad, ya que la mayor parte de los eventos cardiovasculares se presentan en el grupo de la población con riesgo bajo o intermedio. 4
Múltiples biomarcadores adicionales que permiten mejorar la estratificación del riesgo cardiovascular han sido evaluados (moduladores de riesgo). 5 La detección de placas ateroscleróticas carotídeas (PAC) mejora la predicción de eventos cardiovasculares con respecto a la estimación realizada por modelos que solo consideran los factores de riesgo convencionales. 6,7 Asimismo, el puntaje de calcio arterial coronario (pCAC) estimado por tomografía computada multicorte, se asocia fuertemente y de manera gradual con el riesgo de presentar eventos cardiovasculares, independientemente de la edad, el sexo, la etnia y los factores de riesgo tradicionales. 8,9 Finalmente, los niveles elevados de lipoproteína(a) [Lp(a)] se asocian independientemente con mayor riesgo cardiovascular, producto de la activación de mecanismos aterogénicos, inflamatorios y protrombóticos. 10
Considerando lo expuesto previamente, los objetivos de este estudio fueron: 1) determinar la prevalencia de moduladores de riesgo [PAC, pCAC y el nivel de Lp(a)] en una población en prevención primaria estratificada inicialmente a través de un puntaje de riesgo; 2) deter minar la concordancia entre los 2 métodos de detección de ateromatosis subclínica (PAC y pCAC); 3) establecer qué proporción de pacientes deberían recibir estatinas según la estratificación de riesgo inicial y luego de ser recategorizados mediante la pesquisa de moduladores de riesgo.
MATERIAL Y MÉTODOS
El presente es un estudio descriptivo transversal, cuya mues tra se obtuvo en los consultorios de prevención cardiovascular pertenecientes al Servicio de Cardiología de un centro privado de salud de la Ciudad Autónoma de Buenos Aires.
Se incluyeron los pacientes con una edad entre 18 y 79 años, que no presentaban enfermedad cardiovascular o tra tamiento hipolipemiante previo y que acudieron para una evaluación del riesgo cardiovascular.
Definición de las variables
Se calculó el puntaje de riesgo (ASCVD Risk Estimator) utilizado por las guías norteamericanas para el manejo del colesterol (American College of Cardiology/American Heart Association) en los pacientes que contaban con el rango etario y las variables para poder aplicarlo. 11 Los pacientes con un puntaje menor que 5%, entre 5% y 7,4%, entre 7,5% y 19,9%, e igual o mayor que 20%, fueron clasificados como de riesgo bajo, “limítrofe”, moderado y alto, respectivamente.
Se cuantificó la presencia de PAC en forma no invasiva mediante ultrasonido. Se consideró placa cuando se cumplían los siguientes requisitos: 1) espesor de la pared anormal (espesor íntima-media >1,5 mm), 2) estructura anormal (protrusión hacia la luz, pérdida de alineación con la pared adyacente) y 3) ecogenicidad anormal de la pared.
Se calculó el pCAC a través de una tomografía computada multicorte, no contrastada, adquirida con gatillado electrocar diográfico y en una apnea de aproximadamente 5-7 segundos. El calcio coronario se identificó como una zona a nivel del vaso con un umbral de unidades Hounsfield por encima de 130, en un área de al menos 1 mm2. El pCAC obtenido se expresó en unidades Agatston.
El nivel plasmático de Lp(a) fue obtenido mediante la téc nica de nefelometría y se expresó en mg/dL. Un valor mayor o igual a 50 mg/dL fue considerado elevado. Se utilizaron mé todos colorimétricos y turbidimétricos para medir los niveles plasmáticos de triglicéridos, colesterol total y colesterol HDL (C-HDL). Se utilizó la fórmula de Friedewald para calcular el colesterol LDL (C-LDL). 12 La tasa de filtrado glomerular se estimó mediante la ecuación CKD-Epidemiology Collaboration (CKD-EPI). 13 Todos los pacientes realizaron las pruebas en un único laboratorio con la misma metodología.
Para este estudio, y con base en las recomendaciones actuales, se consideró la indicación de estatinas en los si guientes grupos de pacientes en prevención primaria luego de la estratificación inicial mediante datos clínicos y puntaje de riesgo: a) hipercolesterolemia grave (C-LDL ≥190 mg/dL); b) diabetes mellitus; c) insuficiencia renal moderada o grave (tasa de filtrado glomerular <60 mL/min/1,73 m2); d) alto riesgo por puntaje. 11-15 Luego de conocer la información relacionada con la presencia de moduladores de riesgo, se consideraron además los siguientes escenarios clínicos para recomendar estatinas según diferentes guías, documentos de posición y consensos: a) pacientes con riesgo limítrofe o moderado con pCAC >0 14; b) pacientes con riesgo bajo y un pCAC ≥ 100 o pCAC ≥ al percentil 75 esperado para sexo y edad 11,15,16; c) pacientes con riesgo bajo, limítrofe o moderado con PAC 12,13; d) sujetos con riesgo moderado y un valor de Lp(a) ≥ 50 mg/dL17; e) sujetos con riesgo bajo o limítrofe y un valor de Lp(a) ≥ 75 mg/dL. 17)
Análisis estadístico
Se exploró la normalidad de las variables analizando la media, la desviación estándar, la mediana, la skewness, la kurtosis, un histograma y utilizando la prueba de Shapiro-Wilk. La diferencia de variables continuas entre dos grupos se analizó con la prueba de la t si la distribución de los datos era normal o con la prueba de Mann-Whitney-Wilcoxon si no lo era. El análisis de los datos categóricos se realizó con la prueba de chi cuadrado.
Se analizó la concordancia entre los dos métodos para cuantificar ateromatosis subclínica (CAC por tomografía y PAC por ultrasonido) con el índice kappa de Fleiss. Se definió acuerdo pobre, discreto, moderado, sustancial o casi perfecto si el valor de kappa era menor o igual a 0,20, de entre 0,21 y 0,40, de entre 0,41 y 0,60, de entre 0,61 y 0,80 y de entre 0,81 y 1, respectivamente.
Las variables continuas se expresaron como media ± desviación estándar o mediana (rango intercuartílico 25-75) según su distribución, mientras que las variables categóricas se expresaron como porcentajes. Se definió estadísticamente significativo un valor de p < 0,05, utilizando pruebas de dos colas. Para el análisis estadístico se utilizó el programa STATA 11.1.
RESULTADOS
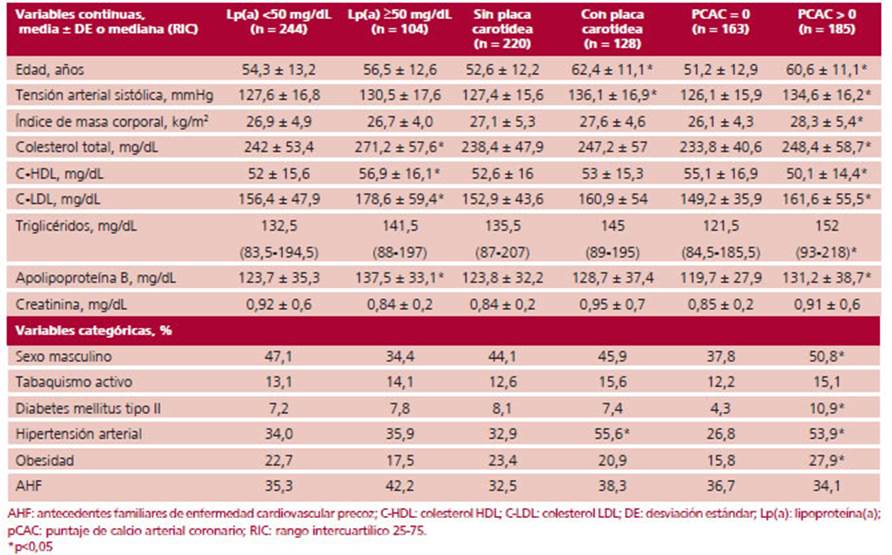
Se incluyeron en nuestro estudio 348 pacientes en prevención primaria que no recibían tratamiento hipolipemiante. La edad media fue 55,6 ± 12,2 años y el 45,4% eran hombres. El 8,1% y el 40,2% mostraron antecedentes de diabetes mellitus tipo 2 o hipertensión arterial, respectivamente. El valor medio de colesterol total fue 242,5 ± 51,9 mg/dL. Las características de la población pueden observarse en la Tabla 1.
El 82,8% (n = 288) de la población tenía las características adecuadas para poder estimar el puntaje de riesgo. Al analizar esta subpoblación, el 37,9%, 14,2%, 32,6% y 15,3% de los pacientes fueron clasificados como de riesgo bajo, “limítrofe”, moderado o alto, respectivamente.
En el 17,2% (n = 60) de la población no se pudo estimar el puntaje de riesgo. Los motivos fueron: una edad menor a 40 años (n = 37), la presencia de hiper colesterolemia grave, colesterol total >320 mg/dL, (n = 20) o ambas condiciones (n = 3).
En total, 29,8%, 36,8% y 53,2% de los pacientes mostraron un valor de Lp(a) ≥50 mg/dL, PAC, o un pCAC > 0, respectivamente. El 17,5% y 8,3% de los sujetos tenía un pCAC ≥100 o ≥300, respectivamente. Sólo 5 pacientes mostraron un pCAC ≥1000.
Los pacientes con niveles elevados de Lp(a) mostraron mayores valores de colesterol total, C-LDL, C-HDL y apolipoproteína B, en comparación con los sujetos con niveles bajos. Los pacientes con PAC tuvieron mayor edad y mostraron más frecuentemente hipertensión arterial en comparación a los pacientes sin ateromato sis carotídea. Finalmente, los individuos con un pCAC >0 mostraron más frecuentemente la mayoría de los factores de riesgo evaluados (incluyendo la edad, el sexo masculino, los valores lipídicos, la obesidad, la diabetes y la hipertensión arterial) en comparación a los pacientes con un pCAC = 0. Las características de la población según la presencia o ausencia de los moduladores de riesgo pueden observarse en la Tabla 2.
En la subpoblación que pudo estratificarse mediante el puntaje de riesgo (n = 288), el 27,2% tenían niveles de Lp(a) ≥50 mg/dL, con una mediana de 25 (9,9-57,7) mg/dL. El 55,9% y el 39,2% de los sujetos tenían un pCAC > 0 o PAC, respectivamente. Además, en el 18,9% y el 29,6% de los pacientes se observó un pCAC ≥100 o ≥ al percentil 75 esperado para su sexo y edad. La presencia de moduladores de riesgo en las diferentes categorías estimadas por el puntaje de riesgo cardiovascular puede observarse en la Figura 1. A pesar de no tener indicación de estatinas, una proporción importante de los sujetos de bajo riesgo (n=109) tenían moduladores de riesgo: Lp(a) ≥50 mg/dl el 25,7%; PAC el 22%; pCAC > 0 el 33%, pCAC ≥ al percentil 75 para sexo y edad, el 33%.
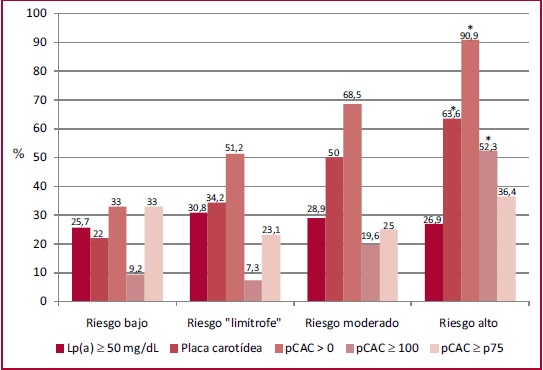
Fig. 1 Prevalencia de los moduladores de riesgo en las diferentes categorías de riesgo cardiovascular (n = 288). *p<0,05
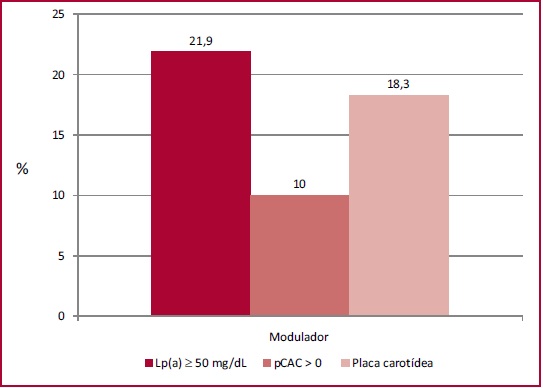
En la subpoblación que no pudo estratificarse aplicando el puntaje de riesgo por tener una edad menor a 40 años y en los que el colesterol total era menor a 320 mg/dL (n = 37), la mediana de Lp(a) fue 18,6 (9,8-36,3) mg/dL, el 18,9% de los pacientes con un valor ≥ 50 mg/dL. El 8,1% y el 2,7% de los pacien tes tenían un pCAC >0 o PAC, respectivamente, con una prevalencia total de aterosclerosis subclínica del 11%. Vale la pena destacar que en los sujetos menores de 45 años y colesterol total <320 mg/dL (n = 60) la prevalencia de PAC fue de 18,3% mientras que el 10% tuvieron pCAC >0 (ningún paciente mostró pCAC ≥100). La prevalencia total de ateromatosis subclínica en sujetos menores de 45 años fue del 23%. La representación gráfica de la prevalencia de los moduladores del riesgo cardiovascular en dicha subpoblación puede observarse en la Figura 2.
En la subpoblación que no pudo estratificarse apli cando el puntaje de riesgo por tener hipercolesterolemia grave (n = 23), la mediana de Lp(a) fue 54,3 (20-72) mg/dL, el 55% de los pacientes con un valor ≥50 mg/dL. Asimismo, el 91,3% y el 65,2% de los pacientes tenían un pCAC >0 o PAC asociada, respectivamente. Además, el 25% y el 66,7% de los pacientes mostraron un pCAC ≥100 o ≥al percentil 75 esperado para su edad. La repre sentación gráfica de la prevalencia de los moduladores del riesgo cardiovascular en dicha subpoblación puede observarse en la Figura 3.
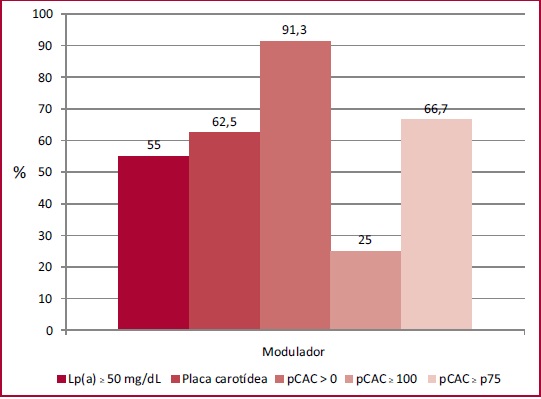
Fig. 3 Prevalencia de moduladores de riesgo en los pacientes con hipercolesterolemia severa (>320 mg/dL, n = 23).
Del total de pacientes con PAC, el 75,8% tenía un pCAC >0. Por otro lado, de todos los pacientes con un pCAC >0, el 52,4% tenía PAC. La concordancia entre los dos métodos para determinar la presencia de ateromatosis subclínica fue discreta (kappa= 0,33), tanto en hom bres (kappa = 0,35) como en mujeres (kappa = 0,30). Por otro lado, la concordancia fue discreta (kappa = 0,29) en los sujetos con una edad mayor o igual a 40 años y moderada (kappa = 0,45) en los pacientes más jóvenes.
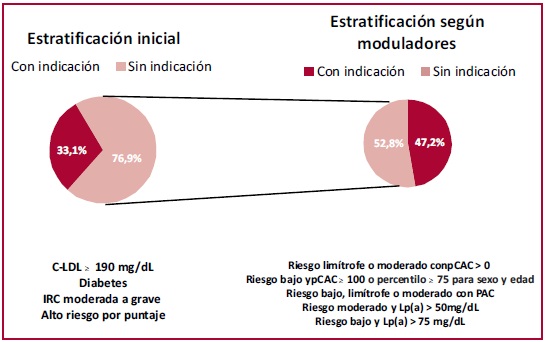
La estratificación inicial basada en los datos clínicos y en el puntaje de riesgo mostró que el 33% (n = 115) de la población sería candidata a recibir estatinas. Sin embargo, al considerar la presencia de moduladores de riesgo, 110 pacientes (47,2%) que inicialmente no eran candidatos para recibir hipolipemiantes cambiarían la indicación (Figura 4).
DISCUSIÓN
Nuestro trabajo expone las limitaciones de estimar el riesgo cardiovascular basándonos exclusivamente en un puntaje de riesgo, ya que muchos pacientes, jóvenes o con un puntaje de riesgo bajo, tenían ateromatosis subclínica o niveles elevados de lipoproteína(a).
En nuestro estudio, no se pudo aplicar el puntaje de riesgo en 37 sujetos con una edad menor a 40 años que no eran portadores de hipercolesterolemia grave. En los 60 pacientes menores de 45 años, a pesar de tener disponible el resultado del pCAC, no fue factible la evaluación del percentil > 75 por sexo y edad, ya que los estudios epidemiológicos no reportaron los percentiles en ese grupo etario. Contar con estos resultados es clínicamente relevante ya que, aproximadamente, entre el 3% y el 10% de los síndromes coronarios agudos ocurren en pacientes muy jóvenes. 18 A pesar de estos resultados, el riesgo cardiovascular es a menudo subestimado en esta población. Los pacientes muy jóvenes que debutan con enfermedad coronaria muestran una alta prevalencia de sobrepeso, tabaquismo e hiperlipidemia. 19 Nuestros datos mostraron que aproximadamente uno de cada 4 a 5 sujetos menores a 45 años tenían ateromatosis subclínica (18% PAC, 10% pCAC>0). Hallazgos similares fueron reportados recientemente por Razavi y col., en cuyo estudio uno de cada diez jóvenes en la población general y uno de cada tres jóvenes con factores de riesgo tradicionales tuvieron un pCAC elevado. 20 Además, un estudio de cohorte, que incluyó más de 13 000 sujetos de 30 a 49 años encontró una prevalencia de pCAC >0 de 20,6%. En el seguimiento alejado, el pCAC fue predictor in dependiente de eventos vasculares y mortalidad. 21 También, otro estudio evaluó la presencia de ateromatosis subclínica en una población muy joven (entre 14 y 40 años). La prevalencia de PAC fue de 5,2%, y más relevante aún, su presencia se asoció de forma independiente con una mayor incidencia de eventos cardiovasculares y mortalidad en el seguimiento. 22
Por otro lado, si bien nuestro trabajo mostró que, a mayor riesgo estimado con el puntaje de riesgo, mayor prevalencia de ateromatosis subclínica, un tercio de los pacientes clasificados como de “bajo riesgo” mostraron un pCAC >0 y uno de cada 5 sujetos tenía PAC. Simi lares resultados fueron reportados en estudios previos, en que entre el 20 y 30% de los pacientes clasificados como de “bajo riesgo” por varios puntajes mostraron PAC. 23,24 Asimismo, en los grandes estudios poblacionales, el porcentaje de pacientes de “bajo riesgo” que fueron reclasificados al considerar el pCAC osciló entre 11% y 15%. 25 Si bien los porcentajes son más bajos que los reportados en nuestro trabajo, hay que considerar que nuestra muestra de pacientes está constituida por individuos que consultaron para evaluar su riesgo cardiovascular, y que tenían una mayor prevalencia de factores de riesgo en comparación a la población general.
Es claro que los sujetos con hipercolesterolemia grave (muchos de ellos con hipercolesterolemia familiar), los cuales no se pudieron estratificar utilizando el puntaje de riesgo, constituyen una población de mayor riesgo cardiovascular. Si bien la presencia de modula dores de riesgo en esta población agrega información pronóstica, 26-29 no cambia la indicación inicial de administrar estatinas de alta intensidad. Nuestro trabajo mostró una alta prevalencia de moduladores de riesgo en esta subpoblación, en coincidencia con otras publicaciones. Solo menos del 9% de los pacientes con hipercolesterolemia grave no tenían ateromatosis coronaria subclínica, mientras que el 65% tenía compromiso aterosclerótico de ambos territorios.
La evidencia actual sugiere que la estimación del pCAC predice mejor los eventos cardiovasculares que la presencia de PAC. (30) Sin embargo, la concordancia entre ambas determinaciones para detectar ateromatosis subclínica fue baja en nuestro trabajo. En otras palabras, y coincidentemente con datos ya reportados por nuestro grupo, una ecografía Doppler carotídea “normal” no excluye la presencia de aterosclerosis subclínica coronaria y viceversa. 31 Además, nuestros hallazgos coinciden con los reportados por Moreyra y col., en que la concordancia entre los territorios coro nario y carotídeo en sujetos en prevención primaria fue débil (kappa 0,21). 32
Otro hallazgo interesante de nuestro trabajo es que aproximadamente entre un 25 y 30% de los pacientes mostraron un nivel elevado de Lp(a)., incluyendo al subgrupo de bajo riesgo. Excepto por el perfil lipídico, no hubo tampoco una asociación significativa entre los valores altos de Lp(a) y los factores de riesgo tradicionales. La asociación entre los valores elevados de Lp(a) y el mayor riesgo de desarrollar enfermedad cardiovascular ha surgido de estudios epidemiológicos y genéticos. 33,34 La activación de mecanismos pro-aterogénicos, proinflamatorios y protrombóticos explicarían la asociación de esta lipoproteína con el incremento del riesgo cardiovascular. 35 Recientemente, un documento de posición europeo recomienda medir la concentración de Lp(a) al menos una vez en la vida en la población adulta. Sin terapias específicas para reducir los niveles de Lp(a), dicho consenso recomienda contrarrestar el nivel elevado de Lp(a) mediante el control temprano e intensivo de los factores de riesgo, fundamentalmente el tratamiento de la hipertensión arterial y la reducción del C-LDL. 17
Adicionalmente, varias guías de prevención car diovascular recomiendan la pesquisa de ateromatosis subclínica, fundamentalmente en los pacientes con “riesgo intermedio”, como un medio útil para reclasificar a los pacientes. 11,14,16. El principal objetivo de la reclasificación es identificar mejor a los pacientes que se beneficiarán con el uso de estatinas. Las guías, recomendaciones y consensos de lípidos también utilizan la detección de moduladores de riesgo para recomendar metas de C-LDL y la intensidad del tratamiento hipolipemiante. 11-16 Nuestro trabajo mostró que un 47,2% de los sujetos que inicialmente no eran candidatos para recibir estatinas, lo fueron al ser reclasificados mediante la detección de moduladores de riesgo. Por lo tanto, utilizando está modalidad híbrida de evaluación del riesgo vascular, recomendaríamos la indicación de estatinas en el 65% de nuestra muestra poblacional. A nuestro criterio, y considerando nuestros resultados, la pesquisa de moduladores de riesgo debería ser considerada también en los estratos de riesgo bajo.
Finalmente, la estrategia de estimar el riesgo cardiovascular basada en los puntajes de riesgo prácticamente no fue evaluada en ensayos clínicos aleatorizados. Recientemente, un estudio mostró que la estratificación de riesgo basada en el pCAC, en comparación a una estrategia basada en el puntaje de riesgo, puede ser más eficiente, personalizada, rentable y motivadora para el inicio y mantenimiento de estatinas en pacientes en prevención primaria. 36 Si esto además se traduce en una reducción de eventos cardiovasculares se está evaluando en un gran ensayo a largo plazo. 37
Nuestro estudio tiene ciertas limitaciones. Por un lado, en este trabajo sólo se utilizó el puntaje de riesgo recomendado por las guías norteamericanas. La aplicación de otras funciones de riesgo podría cambiar los resultados. Por otro lado, los criterios para considerar las indicaciones de estatinas fueron seleccionados por el grupo de investigadores, basándonos en varias guías locales e internacionales vigentes. Finalmente, dado el diseño observacional de nuestro trabajo, es esperable la presencia de sesgos y confundidores.
CONCLUSIÓN
La presencia de moduladores de riesgo fue frecuente en esta población en prevención primaria, incluso en los sujetos de bajo riesgo o en los individuos jóvenes. Considerar la pesquisa simultánea de varios moduladores de riesgo podría optimizar la estratificación inicial de nuestros pacientes y reconsiderar el tratamiento con estatinas.