1. INTRODUCCIÓN
En Ecuador continental, tradicionalmente se explotan plantaciones con algunas especies forestales nativas e introducidas, principalmente balsa - Ochroma pyramidale (Cav. ex Lam.) Urb., pachaco - Schizolobium parahyba (Vell.) S.F. Blake, melina - Gmelina arborea Roxb., laurel - Cordia alliodora (Ruiz & Pav.) Cham., eucalipto - Eucalyptus globulus Labill., E. urophylla S.T. Blake X E. grandis W. Mill ex Maiden, E. saligna Sm. y pino - Pinus radiata D. Don, P. patula Schltdl. & Cham.; sin embargo, el aprovechamiento intensivo de esas especies han provocado erosión de su reducida base genética, cuyos individuos sobresalientes se han tornado cada vez más escasos para cubrir la demanda interna y externa de madera de aserrío, industrial o energía de biomasa (MAE, 2010; MAGAP, 2013, Delgado y Játiva, 2010; Grijalva et al., 2016; Limongi et al., 2011; Lascano, 2008; Palacios et al., 2011; Prado et al., 2010). Lo expuesto, ha obligado a poner en agenda la necesidad de buscar nuevas especies forestales con atributos de crecimiento rápido, como potenciales alternativas para contribuir a las crecientes demandas forestales del país.
Paulownia es un género forestal perteneciente a la familia Paulowniaceae (García-Lahera, 2010). Nueve especies de este género son originarias de China, a excepción de P. fortunei (Seem.) Hemsl, que se extienden hasta Vietnam y Laos, mientras que P. tomentosa (Thunb.) Steud crece en Corea y Japón (Zhu et al., 1986). De estas, las especies más utilizadas para proyectos forestales son P. elongata S. Y. Hu, P. fortunei y P. kawakamii T. Itô en razón de sus características de crecimiento rápido (Lucas et al., 2010). En sitios adecuados, un árbol de diez años de edad puede alcanzar volúmenes aproximados de 4.0-4.5 m3, con crecimientos anuales en DAP de 3 a 4 cm (Zhu et al., 1986; Lucas et al., 2010). Tales atributos, a decir de varios autores, se manifiestan en la excelente calidad y belleza de su madera, su considerable producción de biomasa y capacidad de fijación de CO2, potencial de aprovechamiento del follaje para el ganado, y también para programas de reforestación de tierras abandonadas y/o degradadas, además de sus atributos ornamentales (Wayne y Donald, 2004).
Paulownia se propaga normalmente por semilla que tiene un periodo de dormancia, característica que da lugar a una alta heterogeneidad en una plantación (Castellanos et al., 2006) y a problemas en su manejo silvicultural (Bergmann y Moon, 1997). Para enfrentar esas limitantes, hoy en día se utiliza la propagación clonal que consiste en clonar plantas con características superiores para obtener rodales homogéneos y abastecer una producción forestal de mayor escala. Este tipo de multiplicación utiliza diversos tejidos con objetivos distintos, los segmentos foliares e internodales son utilizados como explantes para embriogénesis somática indirecta (Castillo et al., 2012). Trabajos realizados con P. elongata han reportado promedios de 50.7 embriones somáticos (Ipekci y Gozukirmizi, 2003). Por otra parte, los tejidos más utilizados para la multiplicación clonal son los ápices o yemas axilares en especies tales como P. catalpifolia T. Gong ex D.Y. Hong (Song et al., 1990), P. tomentosa (Rout et al., 2001) y P. fortunei (Sharma et al., 2003). Varios autores han demostrado la propagación in vitro de P. tomentosa mediante regeneración de brotes (Rao et al., 1993) y la multiplicación masiva de P. elongata a través de cultivos nodales y brotes axilares (Bergmann y Whetten, 1998; Ipekci et al., 2001; Lobna et al., 2008).
Adicionalmente, es notable el éxito de la regeneración in vitro que ha permitido controlar algunos factores tales como: los antecedentes genéticos, tipos de tejidos y explantes, componentes nutricionales, condiciones ambientales, conservación de tejidos madre, reguladores de crecimiento (Ozaslan et al., 2005). El género Paulownia se ha utilizado para evaluar sistemas de micropropagación, sin embargo no se reportan protocolos in vitro que permitan obtener altos índices de multiplicación clonal para producir plántulas aclimatadas y listas para ser establecidas en terreno. En el país, tampoco se reportan antecedentes de investigación con cultivo de tejidos aplicados al género Paulownia (Grijalva et al., 2016), por cuya razón el propósito de esta investigación fue evaluar un método de propagación mediante organogénesis directa, para facilitar el establecimiento, multiplicación, enraizamiento y aclimatación de plantas de Paulownia, con fines de propagación a gran escala.
2. MATERIALES Y MÉTODOS
La presente investigación se desarrolló en el laboratorio e invernadero del Departamento de Biotecnología de la Estación Experimental Santa Catalina del INIAP, Ecuador.
Material vegetal
Cuarenta y cinco plantas jóvenes, de aproximadamente 30 cm de altura en promedio, de las especies Paulownia elongata, P. fortunei, y el híbrido (P. elongata x P. fortunei) fueron importadas del World Paulownia Institute (Instituto Mundial de la Paulownia) localizado en Georgia, Estados Unidos. Estas plantas fueron trasplantadas a fundas con una mezcla de tierra y turba (1:1) previamente esterilizada con Benlate 1g L-1 de agua. En esta etapa de pre-adaptación permanecieron por 4 semanas bajo condiciones reguladas de temperatura (25±2 °C), humedad relativa (80 %) y manejo con riego (100 ml planta-1 dos veces por semana) y controles fitosanitarios con Carbendazin en aplicaciones cada 8 días.
Preparación de explantes
Sesenta segmentos nodales, que consisten en yemas axilares y apicales de 1.5 a 3.0 cm de longitud, de las plantas de cada especie (n=180) fueron seleccionados, cortados y sumergidos en tres soluciones distintas. Una primera solución compuesta de agua con detergente para eliminar posibles contaminantes como polvo y corteza. La segunda solución compuesta de povidyn jabón, tween 20 y agua destilada en agitación por 10 minutos. La tercera solución con povidyn 1 % y agua destilada con agitación durante 10 minutos a 70 revoluciones por minuto (RPM). Finalmente, todo el material fue lavado con agua destilada estéril en agitación constante durante 10 minutos a 70 RPM.
Etapa de desinfección
La desinfección se basó en el procedimiento de Castillo et al. (2012), Ipekci et al., (2001) y Ramírez et al., (2001). Para ello, tres grupos de 20 explantes por cada especie del género Paulownia fueron separados. Cada grupo fue expuesto a los diferentes tratamientos de desinfección descritos en la tabla 1. Posteriormente, los desinfectantes fueron removidos de los segmentos nodales realizando tres enjuagues con agua destilada estéril. Adicionalmente, los medios de cultivo fueron elaborados según el procedimiento descrito por M&S (Murashige y Skoog, 1962). De los grupos previamente formados en el procedimiento de desinfección, los explantes fueron subdivididos en grupos de 10 por especie. Posteriormente fueron colocados en los dos tipos de medios de cultivo (Tabla 1) y almacenados por 4 semanas bajo condiciones controladas de temperatura (27 ±1 °C) y luminosidad (16 horas luz-1 día-1).
Etapa de multiplicación
Esta etapa consistió en evaluar el efecto de 4 medios de cultivo especializados para multiplicación sobre el desarrollo de los segmentos nodales desinfectados en la etapa anterior. Estos medios se basaron en diferentes dosis de hormonas ANA y BAP (Tabla 1) y fueron elaborados según el procedimiento descrito por (Murashige y Skoog, 1962). En cada medio de cultivo, se colocaron 10 explantes seleccionados de la etapa anterior y completamente libres de contaminantes. Finalmente, los tratamientos fueron almacenados por 4 semanas, bajo condiciones controladas (27 ±1 °C) y luminosidad (16 horas luz-1 día-1).
Fase de enraizamiento
Esta etapa consistió en evaluar el efecto de tres medios de cultivo semisólidos, especializados para enraizamiento sobre el desarrollo de las raíces de segmentos nodales, seleccionados de la etapa de multiplicación. Estos medios fueron basados en diferentes dosis de hormonas IBA y ANA (Tabla 1) y fueron elaborados según los procedimientos descritos por Castillo et al., (2012), Bergmann y Moon, (1997) y Castellanos et al., (2006). En cada medio de cultivo, se colocaron 10 explantes seleccionados de la etapa anterior. Los tratamientos fueron almacenados por cuatro semanas bajo las mismas condiciones de temperatura y fotoperiodo.
Fase de aclimatación
Esta etapa consistió en evaluar el efecto de dos sustratos distintos sobre el establecimiento de plántulas de las tres especies del género Paulownia seleccionadas de la fase anterior, bajo condiciones de invernadero (Tabla 1). Ambos sustratos fueron esterilizados en autoclave en doble funda durante 30 minutos. Luego, fueron mezclados con agua destilada y finalmente, fueron colocados en macetas previamente desinfectadas con sablón diluido. Adicionalmente, las raíces de 10 plantas por cada especie, seleccionadas de la fase anterior, fueron lavadas con agua tibia estéril para retirar el residuo del medio de enraizamiento y posteriormente fueron colocadas en las macetas con cada sustrato. Las plantas fueron tapadas con un vaso plástico transparente con agujero en la parte superior, y permanecieron en el invernadero por 45 días. En esta fase se realizó riego dos veces por semana y se aplicó fertilizante complejo (11 % N, 5 % P, 5 % K, 0.04 % Cu, 0.04 % Mn y 0.04 % Zn) cada siete días utilizando en dosis de 1 g L-1 de agua.
Registro de datos
Las variables evaluadas fueron agrupadas de acuerdo a las cuatro fases de investigación. En la primera etapa, la contaminación, oxidación, brotación y longitud del brote fueron registradas. Para la contaminación, la presencia o ausencia de micelio de hongos o colonias bacterianas en los explantes y en el medio de cultivo fue registrado a los 15 días. Se calificó con 0 la ausencia total de contaminación y con 1 la presencia de vitropatógenos. También se registró la oxidación en los explantes a los 15 días con 0 la ausencia y con 1 la presencia de oxidación. En brotación, la aparición de yemas fue registrada a los 30 días. Esta variable también fue representada como la ausencia o presencia en cada observación. La longitud del brote fue evaluada a los 30 días. El crecimiento de los brotes fue determinado mediante la medición desde la base del brote hasta el punto más alto de cada segmento nodal. En la segunda fase, la altura de los brotes y el número de segmentos nodales fueron registrados a los 30 días. La altura de los brotes fue medida en centímetros desde la base del tallo hasta la yema terminal, mientras que el número de nudos fue contabilizado. Para la tercera fase, la altura de los brotes, la longitud y el número de raíces fueron registrados a los 30 días. La longitud de raíces fue medida en centímetros desde la base del tallo hasta la terminación de la raíz, mientras que el número de raíces fue contabilizado. El procedimiento de medición de la altura de los brotes fue el mismo que la anterior fase. En la última fase, la longitud de la planta fue registrada a los 30 días, en la cual se siguió el mismo procedimiento de medición que las anteriores fases.
Análisis de los datos
El análisis estadístico se realizó por fases de investigación y tipo de variable. En variables de tipo binomial, tales como: brotación, contaminación y oxidación, un modelo lineal generalizado (MLG) fue aplicado con distribución binomial y función de enlace logit. La variable respuesta se identificó como número de explantes en brotación, contaminados y oxidados respectivamente. Dado que el número de observaciones por cada tratamiento fue de 10 (diez segmentos nodales), la respuesta pudo variar entre 0 y 10, se asumió que la respuesta en estas tres variables era independiente del contenedor (tubo de ensayo) utilizado, entonces la variable de respuesta sigue una distribución binomial con parámetros: π desconocido y n=10, por lo que las 10 observaciones fueron ingresadas en el análisis. Para aquellas variables que resultaron significativas en el MLG (p<0,05), se aplicó la prueba de diferenciación de medias DGC (Di Rienzo et al., 2002). Para las variables continuas: longitud del brote, número de raíces, longitud de raíces y número de nudos, un análisis de la varianza fue aplicado (ANOVA). A las variables que resultaron con significación estadística (p<0.05) se aplicó la prueba de diferenciación de medias de LSD de Fisher. Las variables número de raíces y número de nudos y longitud de brotes en la fase de enraizamiento, fueron transformadas con logaritmo natural para alcanzar homogeneidad de varianzas y normalidad en los residuos. El análisis se realizó en el software Infostat (Di Rienzo et al., 2016).
3. RESULTADOS Y DISCUSIÓN
Etapa de desinfección
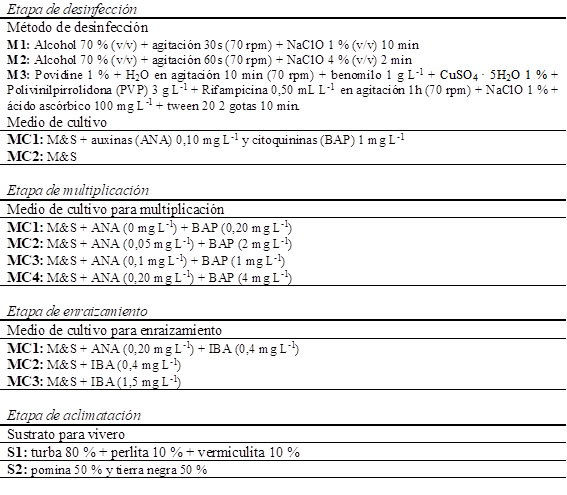
El porcentaje de oxidación en los explantes varió entre 0 y 50 %. Los métodos de desinfección 2 y 3 fueron significativamente menores en porcentaje de oxidación en P. fortunei y el híbrido (P. fortunei x P. elongata), mientras que la respuesta fue similar entre los medios de cultivo con y sin hormonas (Fig. 1 a, b, c). Similares resultados fueron encontrados en el porcentaje de contaminación por vitropatógenos, donde los valores oscilaron entre 0 y 60 % con resultados significativos para las mismas dos especies. En esta variable, los menores valores fueron encontrados con el método de desinfección 3 compuesto por fungicidas/bactericidas +PVP +NaClO +ácido ascórbico +tween 20 independientemente del contenido de hormonas en el medio de cultivo (Fig. 1 d, e, f). Por otra parte, el número de explantes con brotes varió entre 2 y 10, que representa del 20 al 100% de brotación, en donde los métodos de desinfección 3 y 1 fueron más efectivos en P. fortunei, mientras que las otras especies no experimentaron ningún efecto ni del método de desinfección ni del medio de cultivo (Fig. 1 g, h, i). Finalmente, la longitud del brote varió con los tratamientos, particularmente en P. fortunei cuyos mayores valores fueron encontrados en el medio de cultivo con hormonas auxinas (ANA) y citoquininas (BAP) y los métodos de desinfección 1 y 3 (Fig. 1 j). En P. elongata y el híbrido (P. fortunei x P. elongata) la mayor longitud de brote fue observada en el medio de cultivo con hormonas, pero difirieron con el método de desinfección, presentando mayores valores en el método 3 para la primera especie y el método 2 para la segunda (Fig. 1 k, l). Estos resultados pueden deberse a una acción combinada de fungicidas y bactericidas derivados de cobre que actúan como iones cúpricos, inhibiendo una gran variedad de enzimas, provocando la coagulación del protoplasma celular y causan la muerte de la espora del hongo (Espina y Vanegas, 2005). Trabajos relacionados con especies forestales como Salix sp. L. y Aniba perutilis Hemsl., han comprobado que el empleo de una mezcla de fungicidas (Benlate-Captam) y NaOCl al 10 % por 30 y 20 minutos permiten mantener niveles de asepsia mayores al 70 % (Chung y Carrasco, 2002). Por otra parte, Ramírez et al., (2001) señalan que la micropropagación de leñosas en Woody Plant Medium (WPM) al 100 % complementado con vitaminas + 1 mg L-1 de BAP + 0,50 mg L-1 de ANA, se obtiene un 70 % de brotación, mientras que en el presente estudio con la utilización de M&S al 100 % complementado con vitaminas sin reguladores de crecimiento, se obtuvo el 100 % de brotación de yemas, lo que sugiere un efecto significativo del medio base sobre los niveles de brotación de las especies en cuestión y posiblemente una mayor eficiencia productiva de plántulas. Adicionalmente, en tratamientos con 0,10 mg L-1 ANA y 1 mg L-1 BAP se observó la formación de callo embrionario. Similares resultados fueron reportados por Ipekci et al., (2001) en P. elongata utilizando M&S + 4 mg L-1 de BAP y 0,20 mg L-1 de ANA, lo que sugiere un efecto combinado de ambas hormonas como sistema útil para regeneración por embriogénesis y organogénesis indirecta. En tanto que para P. fortunei, las recomendaciones se han centrado en la utilización de M&S + 1 mg L-1 de BAP (Yenkateswarlu et al., 2001).
Etapa de multiplicación
Los resultados de las dosis de hormonas BAP y ANA a los 30 días de cultivo de explantes mostraron una mayor respuesta en la altura de brotes que sobre el número de segmentos nodales. En el caso de los segmentos nodales, el único efecto significativo fue observado en P. fortunei en M&S suplementado con 0,05 mg L-1 de ANA+2 mg L-1 de BAP, que mostró valores por debajo de 15 segmentos nodales planta-1, en comparación con las otras tres dosis de hormonas que presentaron entre 17 y 20 (prueba LDS de Fisher p<0,05). Las otras dos especies P. fortunei y P. fortunei x elongata se destacaron presentando entre 22 y 27 segmentos nodales planta-1, pero sin mostrar diferencias significativas. La altura de brotes de cada especie varía con los diferentes medios de cultivo para multiplicación entre 3 y 8 cm aproximadamente (Figura 2). Las tres especies presentan los mayores valores con el método de multiplicación 1 (BAP 0,20 mg L-1), aunque P. fortunei es significativamente menor en comparación con las otras dos especies. También se observa un decrecimiento de las micro-plantas al adicionar pequeñas dosis de ANA, aunque parece recuperarse al aumentar la dosificación de ANA y BAP, particularmente P. elongata. Esto sugiere que las hormonas de tipo auxinas afectan el desarrollo de brotes en la etapa de multiplicación independientemente del tipo de especies, al menos que las dosis sean en cantidades superiores a 0,1 mg L-1 (Medio de cultivo para multiplicación 3). Estos resultados sugieren la utilización de bajas concentraciones de citocinina (BAP) y auxinas (ANA) para promover la proliferación y elongación de brotes; lo que difiere de Zayova, (2011) quién utilizó cantidades mayores hormonas para obtener similares resultados. Esto probablemente se deba a que pequeñas cantidades de hormona BAP son sintetizadas por brotes activos de las plántulas, pero es insuficiente para inducir el crecimiento y desarrollo in vitro de los brotes y yemas. Por esta razón, más del 85 % de los medios de cultivo empleados en la micropropagación incluyen algún suplemento de citocinina, por ejemplo, Pérez, (1998) adicionalmente encontró presencia de callos en la base de las plántulas, lo que muestra posibilidades de regeneración por embriogénesis y organogénesis indirecta tal como lo mencionan Castillo et al., (2012) y Ipekci et al., (2001).
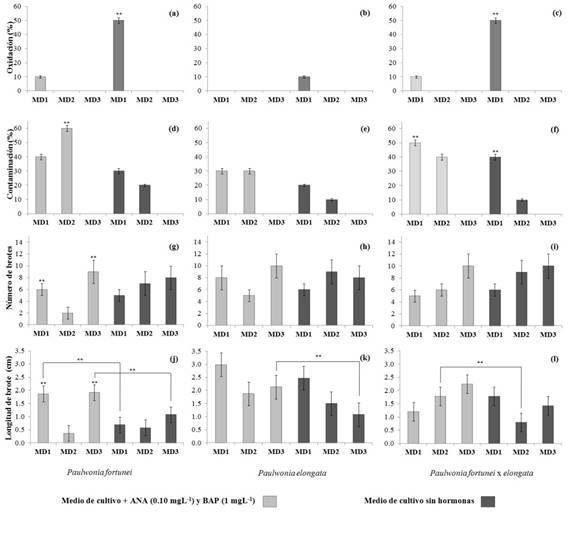
Figura 1. Porcentaje de oxidación, contaminación, número de brotes y longitud promedio de brotes (± error estándar) por especies, métodos de desinfección y medios de cultivo. Las especies están representadas en columnas y variables en filas. Los medios de cultivo se distinguen por colores gris oscuro (sin hormonas) y gris claro (con hormonas) y los métodos de desinfección como MD1 al MD3. Los asteriscos sobre las barras identifican diferencias significativas (p<0,05) entre los métodos de desinfección, mientras que los asteriscos ubicados sobre las líneas muestran diferencias (p<0,05) entre medios de cultivo.
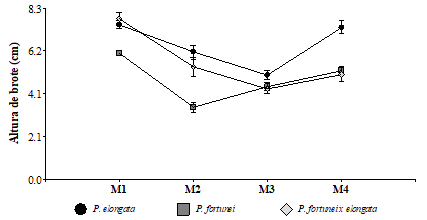
Figura 2. Gráfica que muestra el efecto de la interacción entre los 4 métodos de multiplicación y las tres especies del género Paulownia analizadas sobre la altura de los brotes. La escala de grises y los símbolos describen a las especies. La variable altura de brote fue transformada utilizando logaritmo natural para cumplir con los supuestos de normalidad y homogeneidad de varianzas, sin embargo, en esta gráfica se presentan los valores originales para mayor comprensión.
Etapa de enraizamiento
El efecto de la aplicación de hormonas ANA e IBA en el enraizamiento de micro-plantas de Paulownia indicaron diferencias altamente significativas. En P. fortunei, el medio 3 compuesto por M&S + 1,5 mg L-1 IBA presentó mayor número de raíces (de 6 a 7) y longitud de brote (3,7 cm), y la mayor longitud de la raíz se presentó con el medio 1 (M&S+0,20 mg L-1 ANA+ 0,4 mg L-1 IBA) con 5,20 cm. El híbrido P. fortunei x elongata mostró similar respuesta a diferentes medios. Es así que al mayor número de raíces y longitud de las mismas se presentó con el medio de cultivo 3, y la mayor longitud de brote (3,45 cm) con el medio de cultivo 1 (M&S+0,20 mg L-1 ANA+ 0,4 mg L-1 IBA). Por el contrario, P. elongata mostró una respuesta consistente al medio de cultivo 1 para las tres variables de crecimiento. Bergmann y Moon, (1997) mostraron resultados similares en P. elongata utilizando segmentos foliares de plántulas establecidas in vitro con las mismas hormonas. Chinchilla, (2008) y Ordónez, (2013) mencionan que las respuestas fisiológicas son desencadenadas por la presencia de auxinas, además afirman que IBA en bajas concentraciones favorece el crecimiento primario de la planta y estimulan los procesos de multiplicación celular. Por su parte, Sunseri, (2001) señala que la respuesta fisiológica de elongación celular depende de la interacción de hormonas auxinas añadidas en el medio con las sintetizadas por la propia planta, generando en ocasiones respuestas opuestas a la esperada, a los que nuestro estudio sugiere además que el efecto de las hormonas ANA e IBA tienen un efecto especializado en distintos órganos de la planta en función de las dosis aplicadas.
Etapa de aclimatación
Los resultados en esta etapa mostraron un 100 % de supervivencia en todos los tratamientos y en las tres especies de Paulownia. Adicionalmente, el efecto en altura de planta a los 45 días de evaluación en los dos tipos de sustratos, indican diferencias altamente significativas (p<0,0001) únicamente en P. elongata, mostrando mayor altura de planta en individuos colocados en el sustrato pomina 50 % y tierra negra 50 % (>11 cm) y los individuos plantados en sustrato compuesto por turba 80 % + perlita 10 % y 10 % de vermiculita presentaron una altura de planta menor a 9 cm. En el caso de P. fortunei y en el híbrido (P. fortunei x elongata) las plantas presentaron un desarrollo similar independientemente del sustrato utilizado. Esto sugiere que las características físicas de la turba, tales como alta porosidad combinados con retención de humedad pudieron haber ejercido un efecto positivo sobre la capacidad receptora de nutrientes en las plantas y aireación de las raíces en P. elongata, evitando así los niveles de deshidratación y promoviendo el desarrollo en altura de planta, tallo más grueso, hojas anchas, entre otras. Estos resultados mostraron mayor eficiencia en supervivencia y crecimiento de plantas a lo señalado por Clapa et al., (2014), Ipekci y Gozukirmizi, (2003) y Lobna et al., (2008), quienes presentaron menor sobrevivencia de plantas y menor crecimiento en P. elongata y P. kawakami respectivamente con sustratos más porosos. Por lo que el presente estudio sugiere un proceso más eficiente para aclimatación de plantas in vitro.
Tabla 2. Promedio de número de raíces, longitud de raíces (cm) y longitud de brote (cm) (± error estándar) por especies y medio de cultivo de enraizamiento.Los datos de las tres variables fueron transformados con Ln para alcanzar homogeneidad de varianzas, pero para mayor comprensión de los resultados, los valores originales fueron incorporados en esta tabla. Diferentes letras en minúscula muestran diferencias significativas (p<0,05) entre los tres métodos de enraizamiento. Los datos en negrilla resaltan los valores más altos alcanzados en cada variable por cada especie.
4. CONCLUSIONES
El material vegetal de las tres especies del género Paulownia es resistente a la exposición de elementos químicos como el alcohol y el hiploclorito de sodio, lo que permite su desinfección previa al proceso de multiplicación. Sin embargo, la aplicación de fungicidas y bactericidas más el uso de hormonas auxinas y citoquininas son necesarios para asegurar niveles bajos de contaminación por vitropatógenos, sobre todo en P. elongata y el híbrido P. fortunei x elongata, y para fomentar un rápido desarrollo vegetativo de las plántulas en el arranque del proceso de propagación. En la etapa de multiplicación, el desarrollo vegetativo de las plántulas es favorecido por el uso de bajas dosis de hormonas BAP, particularmente la altura de los brotes. Aunque un estudio con dosis superiores a 0,1 mg L-1 de hormonas ANA podría resultar en un método que potencie el desarrollo de los brotes en esta etapa. Adicionalmente, la aplicación de hormonas tipo IBA y ANA ejercen un efecto especializado en el desarrollo radicular y vegetativo de plántulas en función de las dosis aplicadas y la especie en cuestión. Es así que un incremento en las dosis de hormonas IBA favorece el desarrollo en número y tamaño de raíces, mientras que valores bajos favorecen el desarrollo de brotes en el híbrido P. fortunei x elongata y en P. fortunei. Sin embargo, P. elongata es favorecida únicamente por valores bajos de hormona tipo IBA para su estructura radicular y vegetativa en la etapa de enraizamiento. Finalmente, para asegurar un alto rendimiento en término de plantas vivas y crecimiento en altura de planta, en la etapa de aclimatación, el uso de sustratos que proporcionen al menos un 50 % de porosidad son necesarios para asegurar suficiente drenaje, y el otro 50 % con sustratos que contengan elementos nutricionales que puedan ser aprovechados por la planta en esta etapa; aunque esto último aún debe ser estudiado a mayor profundidad.