Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista argentina de endocrinología y metabolismo
versión On-line ISSN 1851-3034
Rev. argent. endocrinol. metab. vol.50 no.4 Ciudad Autónoma de Buenos Aires dic. 2013
REVISIÓN
Osteoimmunología: Una visión integrada de los sistemas inmunológico y óseo. Nuevas perspectivas de las enfermedades óseas
Osteoimmunology: An Integrated Vision of Immune and Bone Systems. Novel Perspectives for Bone Diseases
Bertini K1, Drnovsek M2, Echin M3, Ercolano M2, Mingote E4, Rubin Z5
1Htal. Militar Central,
2Htal. Ramos Mejía,
3Htal. Rivadavia,
4Htal. César Milstein,
5Htal. de Clínicas.
Departamento de Metabolismo Mineral y Osteopatías Metabólicas.
Sociedad Argentina de Endocrinología y Metabolismo. CABA
Correspondencia: Mónica Lucía Drnovsek. División Endocrinología. Htal. JM Ramos Mejía. General Urquiza 609 - C1221ADC-CABA. Argentina.Tel.:1566012335. e-mail: monica.drnovsek@gmail.com
Recibido: 23-01-2013
Aceptado: 11-04-2013
INTRODUCCIÓN GENERAL
Los sistemas inmune y esquelético comparten una serie de moléculas reguladoras incluyendo citoquinas, moléculas de señalización, factores de transcripción y receptores de membrana. En consecuencia, la fisiología y la patología de un sistema pueden afectar al otro. La investigación sobre la destrucción del cartílago y el hueso asociada a la artritis reumatoide, ha puesto de relieve la importancia de la interacción entre ambos sistemas. Modelos animales deficientes en moléculas inmunomoduladoras desarrollan un fenotipo esquelético alterado. Este campo interdisciplinario denominado osteoimmunología ha despertado gran interés en los últimos años. El ligando del receptor activador del NFkB (RANKL), factor esencial para la inducción de la osteoclastogénesis, enlaza los sistemas inmune y esquelético.
La osteoimmunología es importante en la comprensión de la patogénesis de la patología ósea y en el desarrollo de nuevas estrategias terapéuticas para enfermedades que afectan a ambos sistemas.
En esta revisión se analiza el papel del sistema inmune en la regulación del remodelado óseo y en la pérdida ósea asociada en diversas enfermedades. Se presentará este material en tres partes consecutivas:
Parte I: Osteoinmunología: interacción entre el hueso y el sistema inmune.
Parte II: Inmunoregulación de la remodelación ósea.
Parte III: Rol de la inmunología en la patogénesis de la pérdida de masa ósea.
PARTE I
Osteoinmunología: interacción entre el hueso y el sistema inmune
Osteoimmunology: interaction between bone and immune system
RESUMEN
La osteoinmunología es un campo de investigación dedicado al estudio de la interacción entre el sistema inmune y el tejido óseo. Numerosas evidencias demuestran que ambos comparten mecanismos regulatorios. Esta interacción se produce por contacto directo entre las células de ambos sistemas y por la acción de mediadores regulatorios inmunes, citoquinas y factores de crecimiento.
El objeto de esta revisión es proporcionar una visión global de la interacción entre las células óseas y las células inmunes y el rol que desempeñan en el mutuo desarrollo y función.
El mayor conocimiento de la interacción de estos dos sistemas conduce a una mejor interpretación del papel de la inmunología en la patogénesis de la pérdida de la masa ósea.
Palabras clave: Tejido óseo; Sistema inmune; Interacción; Citoquinas; Factores de transcripción.
Los autores declaran no poseer conflictos de interés.
ABSTRACT
Osteoimmunology is a research field that deals with the study of the interaction between the immune system and bone tissue. Enough evidence demonstrates that they share regulatory mechanisms. This interaction occurs through direct contact between the cells of both systems and by the action of immune regulatory mediators, cytokines and growth factors.
The aim of this review is to provide an overview of the interaction between bone and immune cells and the role they play in the mutual development and function.
A greater knowledge of the interaction of these two systems will allow a better understanding of the role of immunology in the pathogenesis of bone mass loss.
Key words: Bone; Immune system; Interaction; Cytokines; Transcription factor.
No financial conflicts of interest exist.
ABREVIATURAS
CD: Célula Dendrítica
cPH: Células progenitoras hematopoyéticas
GM-CSF: Factor estimulante de colonias de granulocitos macrófagos
LT: Linfocito T
LB: Linfocito B
M-CSF: Factor estimulante de colonia de macró- fagos
MO: Médula ósea
OB: Osteoblasto
OC: Osteoclasto
OPG: Osteoprotegerina
pOC: Precursores de OC
PLC: Progenitor linfoide común
PMC: Progenitor mieloide común
PMP: Progenitor multipotencial
RANK: Receptor Activador del NFkB
RANKL: Ligando del RANK
SCF: Factor de células madre
TLR: Toll-Like Receptor
TNF: Factor de necrosis tumoral
INTRODUCCIÓN
El esqueleto es una estructura que cumple funciones de soporte, protección de órganos vitales, almacenamiento de calcio, fósforo y es el sitio principal de hematopoyesis(1). Los huesos son órganos muy dinámicos debido al constante proceso de remodelación ósea por el cual el esqueleto adulto es completamente reemplazado cada diez años(2). En este proceso intervienen dos estirpes celulares provenientes del linaje osteoblástico y del linaje osteoclástico. El acoplamiento entre ambas está finalmente regulado por factores locales y sistémicos para mantener la homeostasis ósea y mineral(3,4). La interacción entre ambas células se produce a través del Receptor Activador del NFkB (RANK) presente en precursores de osteoclasto (OC) y el Ligando del RANK (RANKL) expresado en células de linaje de osteoblastos (OB) presentes en el estroma de la médula ósea (MO).
Las citoquinas, miembros de la familia del ligando de TNF fueron descriptas en la literatura del campo de la inmunología. La citoquina TRANCE (TNF related activation induced cytokine por sus siglas en inglés) fue considerada una citoquina vinculada con la capacidad de estimular el crecimiento de los linfocitos T (LT)(5). Anderson y col. clonaron el RANK, miembro de la familia del receptor de TNF a partir de ADN de células dendríticas (CD)(6). En forma cotemporal Simonet y col. describieron un factor inhibidor de la diferenciación osteoclástica que fue denominado osteoprotegerina (OPG)(7). El ligando de OPG fue aislado por dos grupos diferentes de trabajo siendo denominado Factor de Diferenciación Osteoclástica (ODF por sus siglas en inglés) por Yasuda H y col. y Ligando de OPG (LOPG) por Lacey DL y col.(8,9). Es decir que el RANKL, como se lo denomina actualmente, fue identificado en forma independiente por inmunólogos y biólogos óseos quienes lo llamaron TRANCE, ODF y LOPG.
La presencia de MO dentro de la cavidad ósea sugiere una interdependencia entre ambos tejidos. En el hueso se aloja el "nicho hematopoyético", estructura especializada en el que coexisten las células progenitoras mesenquimáticas y hematopoyéticas. Las células progenitoras hematopoyéticas (cPH) multipotenciales, a partir de las cuales derivan todas las células del sistema inmune, se encuentran adyacentes a la superficie ósea, siendo las más cercanas al endostio más proliferativas que las alejadas del endostio(10,11). Las cPH expresan el receptor sensor de calcio por el cual se mantienen cercanas a la superficie del endostio, donde se conserva una alta concentración de calcio en virtud de la actividad de los OC y OB(12). Estudios "in vitro" muestran que el OC juega un rol crítico en la formación del nicho hematopoyético. La ausencia de OC produce defecto en la formación y diferenciación de OB reduciendo su capacidad para atraer cPH, afectando el almacenamiento de estas células en el nicho hematopoyético(13).
OSTEOCLASTOS Y SU INTERACCIÓN CON CÉLULAS HEMATOPOYÉTICAS
Los OC derivan de células de linaje hematopoyético, al igual que los linfocitos, fagocitos y las CD, más precisamente de la línea mieloide-monocítica, conjuntamente con los macrófagos y las CD. La diferenciación hacia uno u otro tipo celular dependerá de factores locales a los cuales está expuesto el progenitor mieloide común (PMC). Muguruma y col. identificaron una población de células progenitoras de OC en MO de murinos negativas para marcadores de LB maduros (CD45R/B220), negativas para granulocitos (Gr-1), macrófagos (CD11b/Mac-1) y células eritroides (Ter-119) pero positivas para un marcador de células progenitoras c-Kit y con capacidad para diferenciarse hacia OC(14).
La célula PMC se identifica por la presencia del marcador de superficie c-Kit que es un receptor específico para el factor de células madre (SCF por sus siglas en inglés), la expresión moderada del marcador de linaje pan-mieloide CD11b y por la ausencia de expresión c-Fms, el receptor para el factor estimulante de colonia de macrófagos (M-CSF) necesario para inducir la diferenciación de las células hacia OC. En esta fracción, c-Kit+, CD11b moderado y c- Fms-, son consideradas multipotenciales debido a su capacidad para diferenciarse también hacia granulocitos, macrófagos y células eritroides(14). La interacción de los monocitos precursores CD11b con SCF induce la expresión de c-Fms. También, el factor de transcripción PU.1, miembro de la familia de factores de transcripción Ets (proteínas de unión a ADN del tipo "helix-loop hélix), implicado en la generación de LB y células de origen mieloide, regula el desarrollo de OC a través del control de la expresión de c-fms(15). De esta forma la célula PMC, madura hacia estadios tempranos de precursor de OC (pOC), c-Kit+, CD11b moderado, c- Fms+. Luego, el M-CSF a través de la inducción transitoria de una alta expresión de CD11b, y por la sobreexpresión de RANK convierte estos pOC tempranos en pOC tardíos(16). Para el proceso de diferenciación de OC es necesaria la presencia de células de linaje osteoblástico que expresan M-CSF y RANKL, ambos necesarios para la diferenciación de los OC(17-19). La unión del RANKL a RANK desencadena la cascada de señalización que, conjuntamente con las señales coestimulatorias mediante el receptor asociado a OC (OSCAR por sus siglas en inglés) culmina en la formación de OC maduros(20) . (Fig. 2)
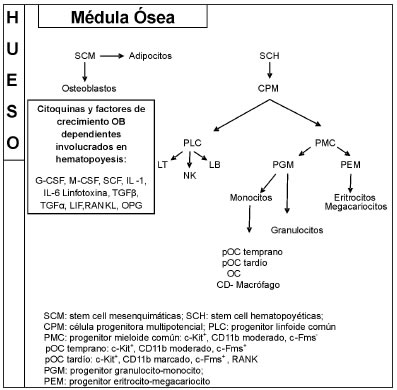
Figura 2. Nicho hematopoyético: interacción de los OB con hematopoyesis.
Los macrófagos son otro tipo de células del sistema inmune que pueden dar origen a los OC(21). Si bien los macrófagos y OC expresan algunos antígenos en común, muestran diferencias en la expresión de antígenos de superficie que separan ambos tipos de células(22,23). Los macrófagos tienen la propiedad de fusionarse dando lugar a la formación de células multinucleadas denominadas polikarions. El medio local de citoquinas permitirá la diferenciación del macrófago hacia la forma de células multinucleares polikaryons o hacia OC. La presencia de RANKL direcciona la diferenciación de los macrófagos hacia OC y la presencia de interleucina 4 (IL-4) direcciona la diferenciación de los macrófagos hacia polykaryons(24,25).
La fusión de los pOC en OC maduros es un proceso regulado por la interacción entre la proteína CD200, fuertemente expresada en macrófagos en estadio previo a la fusión y CD200R (Receptor de CD200) expresado en células del linaje mieloide, incluso los OC. Los OC de ratón nulo CD200 R -/- presentan una disminución de la tasa de diferenciación hacia OC, menor número de OC y aumento de la masa ósea(26).
La proteína de transmembrana específica de CD (DC-STAMP) identificada inicialmente en CD, se expresa también en macrófagos y OC(27). En macrófagos derivados de MO esta proteína es esencial para la formación de células gigantes multinucleadas en presencia de IL-4 y para la formación de OC en presencia de RANKL y M-CSF(28-30). Los ratones
nulos para DC-STAMP presentan osteopetrosis y ausencia de OC(31).
Los precursores monocíticos se diferencian hacia CD en presencia de GM-CSF e IL-4. La CD, cuya función es la de presentar el antígeno al LT como parte de la respuesta inmune adaptativa, comparte un precursor común con los OC y macrófagos(32). Estudios "in vitro" han mostrado que las células humanas y murinas que expresan marcadores tempranos del linaje de células mieloides dendríticas pueden diferenciarse hacia OC(33,34); incluso en estadios de maduración más avanzados pareciera que retienen la capacidad de diferenciarse hacia OC cuando son tratadas con M-CSF y RANKL(35). Este proceso de transdiferenciación de la CD hacia OC ocurre en dos etapas: inicialmente las células se diferencian hacia un modelo celular intermedio que expresa marcadores de macrófagos (CD11b, CD14, CD16) y marcadores de CD (CD1a, CD80, CD86, CD11c, HLA-DR); en una segunda etapa con el cese de la proliferación celular se produce down regulación de los marcadores de superficie y comienza el proceso de fusión celular y diferenciación hacia OC funcionales TRAP+ (fosfatasa ácida tartrato resistente),CL-R+ (receptor de calcitonina) y catepsina-k+ (35). Este proceso de transdiferenciación de las CD se hace manifiesto en estados de inflamación crónica(36).
Recientes estudios describen un probable rol de los OC en el proceso de eflujo de cPH desde la MO hacia la periferia. El tratamiento de ratones con RANKL indujo el desarrollo y expresión de metaloproteinasa 9 (MMP9) y catepsina-k en OC conjuntamente con la movilización de cPH desde la MO. Estas enzimas, además de degradar proteínas óseas, tienen la capacidad de clivar un factor de crecimiento y de adhesión para células progenitoras. Sin embargo, el tratamiento con RANKL de ratones que presentan defecto en la actividad resortiva de OC [deficientes en proteína tirosina fosfatasa épsilon (PTPe)] no se acompaña de movilización de células progenitoras desde la MO hacia periferia. Estos hallazgos vincularían la remodelación ósea con la hematopoyesis(37).
OSTEOBLASTOS Y SU INTERACCIÓN CON CÉLULAS HEMATOPOYÉTICAS
Los OB derivan de células mesenquimáticas multipotenciales que pueden diferenciarse también hacia células del estroma de la MO y adipocitos(38). Si bien, las señales regulatorias de la osteoblastogénesis no han sido completamente elucidadas, se han identificado ciertos factores de transcripción de acción paracrina y/o autocrina como Runx 2, Osterix, TGFß y proteínas morfogénicas óseas (BMP por sus siglas en inglés) que inician la señal de osteoblastogénesis(39-44). La vía de señalización de Wnt/ß-catenina interviene en el direccionamiento de la célula mesenquimática hacia OB o adipocito(45,46). Los OB maduros se encuentran en aquellos sitios de la superficie ósea donde se produce formación ósea activa. El 50 % a 70 % de los OB maduros sufren un proceso de apoptosis, el resto se diferencian hacia osteocitos o hacia células quiescentes de superficie también llamadas células de revestimiento.
Los osteocitos quedan atrapados en la nueva matriz ósea formada. Se encuentran conectados entre sí, con las células de superficie y con los OB mediante procesos citoplasmáticos. Recientes estudios han mostrado que los osteocitos expresan RANKL. El ratón carente de RANKL osteocito específico presenta un fenotipo de osteopetrosis, sugiriendo que estas células son una fuente importante de RANKL durante la remodelación ósea (47). La esclerostina, proteína secretada por el osteocito, regula la vía de señalización Wnt/ß-catenina en el OB inhibiendo su proliferación e induciendo su apoptosis(48,49). Un estudio reciente muestra que la esclerostina también podría promover la formación y actividad del OC en forma RANKL dependiente(50). (Fig. 1)
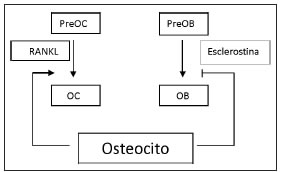
Figura 1. Modelo de regulación de la formación y resorción ósea mediada por osteocitos
Las células de revestimiento se encuentran en la superficie ósea quiescente. Se cree que las señales que inician la formación de los OC inducen a las células de revestimiento a preparar la superficie ósea para su resorción(51). Estas células que también expresan RANKL son responsables de la interacción con RANK presente en pOC(52).
La diferenciación de las cPH ocurre en proximidad a los OB del endostio. La retención de las células madre en la médula ósea es un proceso mediado principalmente por el eje CXCL12-CXCR4. La quimoquina CXCL12 expresada por las células que conforman el microambiente, sobre todo OB y células estromales, interactúa con su receptor CXCR4 expresado en las cPH reteniendo a dichas células en el endostio para generar el reservorio celular en la MO. La anexina II, proteína expresada por los OB favorece la adhesión de las cPH en la MO(53,54).
Las células de linaje osteoblástico secretan varias citoquinas y factores de crecimiento involucrados en la hematopoyesis [(Factor estimulante de colonias granulocítico (G-CSF), M-CSF, IL-1, IL-6, linfotoxina, TGFß, TNFa, factor inhibitorio leucémico (LIF por sus siglas en inglés), SCF](55-57). Taichman y col. demostraron que los OB humanos soportan la hematopoyesis. El cultivo de células hematopoyéticas CD34+ sobre monocapa de células de linaje osteoblástico se acompañó de incremento en el número de células hematopoyéticas(58).
La expansión de células de estirpe osteoblástico mediante estimulación del receptor de PTH/PTHRP se acompañó de incremento del número de cPH en la MO. Contrariamente la destrucción de células de la progenie osteoblástico produce descenso de cPH en la MO(59,60).
Las células de linaje de OB también podrían sostener la diferenciación de megacariocitos. El cultivo de cPH CD34+ sobre OB normales en presencia de citoquinas como SCF, IL-3, IL-11, y trombopoyetina se acompañó de expansión de megacariocitos tempranos CD34+CD41+(61).
Los factores de transcripción GATA-1 y p45NF-E2 juegan un rol crítico en la diferenciación de los megacariocitos. El ratón nulo en GATA-1 así como el ratón nulo en p45NF-E2 presenta acumulación de megacariocitos en estadio inmaduro y aumento del número de OB en MO(62-64). Este hallazgo sugiere una potencial interacción entre las células de línea osteoblástica y las de línea megacariocítica. Estudios "in vitro" muestran que los megacariocitos tendrían una acción estimulando la proliferación y diferenciación de los OB(65,66). Por otro, lado ha sido demostrada la expresión de OPG y RANKL en megacariocitos, a través de las cuales podrían estar regulando la masa esquelética(67-69).
LINFOCITOS
Los LB responsables de la producción de anticuerpos, conjuntamente con los LT forman parte del sistema inmune adaptativo por el cual un individuo desarrolla respuestas específicas frente a un agente patógeno y tiene capacidad de desarrollar memoria permitiendo una respuesta más robusta ante una segunda infección producida por el mismo patógeno.
Los LB se originan a partir de las cPH en los nichos hematopoyéticos. Las cPH se encuentran en contacto con células de la superficie ósea del endostio, siendo las células del linaje de OB a través de citoquinas y factores de crecimiento las que soportan su diferenciación(70,60). Estudios "in vitro" muestran que es necesario el contacto con OB para inducir la producción de precursores de células B a partir de sus progenitores(71). La acción de la PTH/PTHrP a través de su receptor en OB induce la expresión de IL-7 y de la quimoquina CXCL12. Los ratones con defecto en la vía de señalización de PTH por ablación de la proteína Gsa en OB presentan disminución de la expresión de IL-7 y un 50 % de reducción de células B en MO sin afectación de otras líneas hematopoyéticas(72).
Las cPH tienen la capacidad de auto-renovarse y de dividirse formando células hijas que en cada estadio de diferenciación se tornan más restringidas en términos de linaje celular. En estadio de PMP (progenitor mieloide pluripotencial) se produce una separación hacia PLC (progenitor linfoide común) que dará origen a LB, LT y Natural Killer y PMC a partir del cual se originan OC, macrófagos, CD, granulocitos, megacariocitos y eritrocitos(73) (Fig. 2). Los distintos estadios de diferenciación linfocitaria se caracterizan por patrones de expresión de genes específicos de las células linfoides. Estos dependerán de la expresión o represión de proteínas que están bajo el control de factores de transcripción como PU.1, Ikaros, E2A, Ebf1 y Pax5. Muchos de estos factores de transcripción actúan también en el desarrollo de las células óseas.
PU.1 es un factor de transcripción de la familia Ets, requerido para el desarrollo tanto del las células del linaje mieloide como linfoide(74). El ratón nulo en PU.1 carece de LB, LT y presenta fallas en el desarrollo de macrófagos y OC. Esto demuestra el rol central de este factor de transcripción en la evolución del linaje mieloide y linfoide(75,76).
Ikaros es un factor de transcripción de la familia "Kruppel-like zinc finger". Está ampliamente expresado en células de linaje hematopoyético. El ratón deficiente Ikzf1-/- tiene menor actividad de cPH, PMP, lo cual resulta en falla completa en el desarrollo de LB, falla en desarrollo de LT y aumento de la mielopoyesis. No se conoce si el aumento de la mielopoyesis se refleja en aumento de osteocalstogénesis(77-79).
E2A es miembro de la familia de protein-E de proteínas básicas "helix-loop-helix que ligan elementos E-box para regular la transcripción. La pérdida de este factor se acompaña de detención en estadios tempranos de desarrollo de LB(80). Actúa en concierto con Ebf1 direccionando a los progenitores hacia la diferenciación de LB.
Ebf1 es miembro fundador de una pequeña familia de multigenes que codifican proteínas conservadas evolutivamente y que tienen roles definidos en la diferenciación y función celular. Se expresa en células de linaje temprano de LB, en adipocitos y células de linaje de OB. Los ratones Ebf1-/- presentan aumento de todos los parámetros de formación ósea así como aumento del número de OC con el avance de la edad; asimismo el desarrollo del LB se encuentra bloqueado en estadios tempranos de la diferenciación(81,82).
Pax5 es miembro de una familia de multigenes que codifica factores de transcripción "paired box". El gen Pax5 codifica para un factor de activación específico para linaje de LB (BSAP por sus siglas en inglés). En el sistema hematopoyético el BSAP se expresa exclusivamente en linaje de células B(83). Aunque los OC y los LB se originan a partir de diferentes progenitores, existen datos que sostienen la hipótesis de que las células B y los macrófagos pueden diferenciarse a partir de un progenitor común posterior a PMC. El hecho de que el cultivo de células progenitores de LB "CD45R/B220-CD19+", aisladas de MO de ratón adulto en condiciones de estimulación mieloide da origen al desarrollo de macrófagos indica la naturaleza bipotencial de estas células(84). La pérdida de Pax5 ocasiona la expresión de genes no deseados como c-fms favoreciendo la diferenciación hacia macrófagos y OC. Es decir que la pérdida de Pax5 podría inducir la capacidad bipotencial de las células progenitoras. El ratón nulo Pax-/- tiene un fenotipo óseo que se caracteriza por reducción en el volumen y osteoide óseo, marcado aumento en el número de OC y descenso no significativo de los OB(85).
INTERACCIÓN ENTRE EL HUESO Y SISTEMA INMUNE
Los procesos de modelado y remodelado óseo involucran interacciones complejas entre los OB y OC con producción de citoquinas y generación de factores de acoplamiento durante la resorción ósea(86).
Los OB y otras células mesenquimáticas proveen señales moleculares como citoquinas, quimoquinas y factores de crecimiento que controlarán el destino de las cPH en términos de auto-duplicación, proliferación, diferenciación y almacenamiento(87). Por otro lado, factores secretados por las células inmunes actúan sobre los OC y OB(88,89). Varios estudios muestran que la inducción de la osteoclastogénesis puede llevarse a cabo vía activación de RANK o TLR (Toll-Like Receptor por sus siglas en inglés). Ambas vías utilizan una molécula de señalización común en la vía de la osteoclastogénesis (TRAF6: factor 6 asociado a receptor de TNF)(90).
Los TLRs se expresan en células del sistema inmune y también en células del linaje de OC y OB(91,92). Los TLRs pertenecen a un grupo de receptores que reconocen moléculas específicas de microorganismos, iniciando la respuesta de defensa rápida mediada por el sistema inmune innato a través de la producción de citoquinas proinflamatorias(93,94). Es decir, que la activación del sistema inmune afecta el metabolismo óseo a través de la producción de citoquinas, las cuales pueden ser estimulatorias o inhibitorias de la osteoclastogénesis. Por consiguiente, moléculas específicas de microorganismos podrían modular la célula ósea en forma indirecta a través del sistema inmune o interactuando en forma directa con la célula ósea como se describe en la periodontitis(91).
También, se describe una modulación diferencial de la osteoclastogénesis a través de la activación de TLR. La activación de TLR sobre precursores tardíos de OC, OC maduros y OB resulta en un incremento de la osteoclastogénesis. Este sería el mecanismo de pérdida ósea inducida por patógeno(95). Contrariamente, la activación de TLR en precursores tempranos de OC ejercería un efecto inhibidor de la osteoclastogénesis(96,94).
Los complejos inmunes producidos por daño tisular como consecuencia de la activación del sistema inmune innato en el lupus eritematoso sistémico, actúan como potentes activadores endógenos de TLR(97).
La producción de citoquinas inflamatorias por células inmunes ha sido vinculada principalmente a procesos patológicos que involucran al hueso. La expresión de RANKL en células inmunes como LT (Th1, Th2, Th17 y Treg) y RANK en CD facilita un mecanismo de comunicación entre el sistema inmune y el hueso(98,99). Estudios "in vitro" muestran que los LT activos o el sobrenadante obtenido de cultivos de LT activos es capaz de estimular la osteoclastogénesis. Es decir que los LT activos a través de la expresión de RANKL tienen la capacidad de inducir la diferenciación de OC actuando en forma directa sobre los precursores de OC(100).
Los LT activos secretan varias citoquinas por lo que su efecto sobre la osteoclastogénesis dependerá del balance entre citoquinas antiosteoclastogénicas (INF?, IL-4, OPG, proteína citotóxica 4 LT) y proosteoclastogénicas (IL-17 )(101) (Tabla 1) En la artritis autoinmune la IL-17 cumple un rol crítico en la resorción ósea y ha sido detectada en líquido sinovial de pacientes con artritis reumatoidea(102,103).
Tabla 1. Citoquinas Linfocito T dependientes y osteoclastogénesis
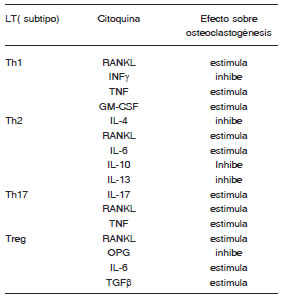
Abreviaturas: RANKL,Ligando del Receptor Activador del NFkB; INF?, interferon ?; TNF, factor de necrosis tumoral; GM-CSF, factor estimulante de colonia macrófago-granulocito; IL, interleucina;OPG, osteoprotegerina; TGFß, factor de crecimiento tumoral ß, LT: linfocito T, Th: LThelper, Treg: LTregulador
Siempre existen algunos LT activos en el sistema inmune, a pesar de lo cual no siempre se produce pérdida ósea. Esto se debe a que los LT tienen también un mecanismo regulatorio negativo sobre la osteoclastogénesis por la secreción de INF? e IL-4. El INF? a través de su receptor en el OC induce la degradación de la proteína adaptadora TRAF6 y la IL-4 reduce la translocación nuclear y el binding de NFkB a los elementos respondientes de ADN boqueando así la osteoclastogénesis(104,105). Por otra parte cuando las CD presentan el antígeno al LT inducen la expresión de RANKL en LT, el cual a su vez proporciona señales de sobrevida a las CD. Luego la vía de señalización de CD40 (proteína coestimuladora de célula presentadora de Ag) expresado en CD y CD40L (ligando de CD40) expresado en LT aumenta la expresión de OPG en la CD. De esta forma se inhibe la actividad de RANKL en un circuito de retroalimentación negativa que limita la activación de LT por la CD(106). (Fig. 3)
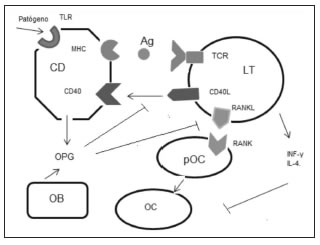
Figura 3. modelo celular de Interacción entre LT y homeostasis ósea. Ag: antígeno; TLR: toll-like receptor; TCR: receptor de LT; MHC: complejo mayor de histocompatibilidad. CD40: proteína coestimuladora de célula presentadora de Ag; CD40L: ligando de CD40
Se cree que en condiciones fisiológicas el RANKL del sistema inmune no cumpliría un rol principal.
Existe una gran cantidad de citoquinas producidas por LT activos capaces de regular al OB. Producen sustancias capaces de direccionar la diferenciación de las células del estroma medular hacia el fenotipo de OB. El TNFa es un potente factor proapoptótico e inhibidor de la diferenciación y función del OB y el IFN-ginhibe la síntesis de colágeno en los OB(107,108). Estudios "in vivo" e "in vitro" muestran que la IL4 y la IL13 estimulan la proliferación e inhiben la diferenciación de los OB(109,110). La IL10 producida por LT y LB activos inhibe la síntesis de proteínas de origen osteoblástico e inhibe el proceso de mineralización(111).
CONCLUSIÓN
El sistema inmune y el esqueleto se encuentran íntimamente conectados por una regulación cruzada. Ambos comparten mecanismos de señalización y moléculas de regulación como citoquinas, factores de transcripción y receptores. Diversos factores producidos durante la respuesta inmune son capaces de afectar el hueso. El campo de la osteoinmunología abre nuevas perspectivas en el conocimiento del rol de la inmunología en la patogénesis de la pérdida de la masa ósea.
1. Raisz LG, Kream BE, Lorenzo JA, Larsen PR, Kronenberg HM, Melmed S, Polonsky KS. Metabolic bone disease. In: Davies TF, Larsen PR, Kronenberg HM, eds. Williams textbook of endocrinology. Philadelphia: W.B. Saunders; 1373, 2002 [ Links ]
2. Rodan GA, Martin TJ. Therapeutic approaches to bone diseases. Science; 289:1508-1514, 2000 [ Links ]
3. Hill P. Bone remodelling. Br J Orthod; 25:101-7,1998 [ Links ]
4. Raggatt LJ, Partridge NC. Cellular and molecular mechanisms of bone remodeling. J Biol Chem; 285:25103-8, 2010 [ Links ]
5. Wong BR, Josien R, Lee SY, Sauter B, Li HL, Steinman RM, Choi Y. TRANCE (tumor necrosis factor [TNF]-related activation-induced cytokine., a new TNF family member predominantly expressed in T cells, is a dendritic cell-specific survival factor. J Exp Med; 186:2075-2080, 1997 [ Links ]
6. Anderson DM, Maraskovsky E, Billingsley WL, Dougall WC, Tometsko ME, Roux ER, Teepe MC, DuBose RF, Cosman D, Galibert L. A homologue of the TNF receptor and its ligand enhance T-cell growth and dendritic-cell function. Nature; 390:175-179, 1997 [ Links ]
7. Simonet WS, Lacey DL, Dunstan CR, Kelley M, Chang MS, Luthy R, Nguyen HQ, Wooden S,Bennett L, Boone T, Shimamoto G, DeRose M, Elliott R, Colombero A, Tan HL, Trail G, Sullivan J, Davy E, Bucay N, Renshaw-Gegg L, Hughes TM, Hill D, Pattison W, Campbell P, Sander S, Van G, Tarpley J, Derby P, Lee R, Boyle WJ. Osteoprotegerin: A novel secreted protein involved in the regulation of bone density. Cell; 89:309-319, 1997 [ Links ]
8. Lacey DL, Timms E, Tan HL, Kelley MJ, Dunstan CR, Burgess T, Elliott R, Colombero A, Elliott G, Scully S, Hsu H, Sullivan J, Hawkins N, Davy E, Capparelli C, Eli A, Qian YX, Kaufman S, Sarosi I, Shalhoub V, Senaldi G, Guo J, Delaney J, Boyle WJ. Osteoprotegerin ligand is a cytokine that regulates osteoclast differentiation and activation. Cell; 93:165-176,1998 [ Links ]
9. Yasuda H, Shima N, Nakagawa N, Yamaguchi K, Kinosaki M, Mochizuki S, Tomoyasu A, Yano K, Goto M, Murakami A, Tsuda E, Morinaga T, Higashio K, Udagawa N, Takahashi N, Suda T. Osteoclast differentiation factor is a ligand for osteoprotegerin/osteoclastogenesis-inhibitory factor and is identical to TRANCE/RANKL. Proc Natl Acad Sci U S A; 95:3597-3602, 1998 [ Links ]
10. Gong JK Endosteal marrow: a rich source of hematopoietic stem cells. Science; 199:1443-1445, 1978 [ Links ]
11. Kiel MJ, Yilmaz OH, Iwashita T, Yilmaz OH, Terhorst C, Morrison SJ SLAM family receptors distinguish hematopoietic stem and progenitor cells and reveal endothelial niches for stem cells. Cell; 121:1109-1121, 2005 [ Links ]
12. Adams, G.B., K.T. Chabner, I.R. Alley, D.P. Olson, Z.M. Szczepiorkowski, M.C. Poznansky, C.H. Kos, M.R. Pollak, E.M. Brown and D.T. Scadden. Stem cell engraftment at the endosteal niche is specified by the calcium-sensing receptor. Nature; 439:599-603, 2006 [ Links ]
13. Mansour A, Abou-Ezzi G, Sitnicka E, Jacobsen SE, Wakkach A, Blin-Wakkach C. Osteoclasts promote the formation of hematopoietic stem cell niches in the bone marrow. J Exp Med; 209(3:537-49, 2012 [ Links ]
14. Muguruma Y, Lee MY Isolation and characterization of murine clonogenic osteoclast progenitors by cell surface phenotype analysis. Blood; 91:1272-1279, 1998 [ Links ]
15. Takayanagi H. Osteoimmunology: Shared mechanisms and crosstalk between the immune and bone systems. Nat Rev Immunol; 7:292-304, 2007 [ Links ]
16. Arai F, Miyamoto T, Ohneda O, Inada T, Sudo T, Brasel K, Miyata T, Anderson DM, Suda T. Commitment and differentiation of osteoclast precursor cells by the sequential expression of c-fms and receptor activator of nuclear factor {kappa}B (RANK. receptors. J Exp Med; 190:1741-1754, 1999 [ Links ]
17. Takahashi N, Akatsu T, Udagawa N, Sasaki T, Yamaguchi A, Moseley JM, Martin TJ, Suda T Osteoblastic cells are involved in osteoclast formation. Endocrinology; 123(5.:2600-2, 1988 [ Links ]
18. Suda T, Takahashi N, Udagawa N, Jimi E, Gillespie MT, Martin T Modulation of osteoclast differentiation and function by the new members of the tumor necrosis factor receptor and ligand families. Endocr Rev; 20(3.:345-57, 1999 [ Links ]
19. Mochizuki A, Takami M, Kawawa T, Suzumoto R, Sasaki T, Shiba A, Tsukasaki H, Zhao B, Yasuhara R, Suzawa T, Miyamoto Y, Choi Y, Kamijo R Identification and characterization of the precursors committed to osteoclasts induced by TNF-related activation-induced cytokine/receptor activator of NF-?B ligand. J Immunol; 177:4360-4368, 2006 [ Links ]
20. Kim N, Takami M, Rho J, Josien R, Choi Y. A novel member of the leukocyte receptor complex regulates osteoclast differentiation. J. Exp. Med; 195:201-209, 2002 [ Links ]
21. Takeshita S, Kaji K, Kudo A. Identification and characterization of the new osteoclast progenitor with macrophage phenotypes being able to differentiate into mature osteoclasts. J Bone Miner Res; 15:1477-1488, 2000 [ Links ]
22. Sminia T, Dijkstra CD The origin of osteoclasts: an immunohistochemical study on macrophages and osteoclasts in embryonic rat bone. Calcif Tissue Int; 39:263-266, 1986 [ Links ]
23. Tsurukai T, Takahashi N, Jimi E, Nakamura I, Udagawa N, Nogimori K, Tamura M, Suda T Isolation and characterization of osteoclast precursors that differentiate into osteoclasts on calvarial cells within a short period of time. J Cell Physiol; 177:26-35, 1998 [ Links ]
24. Chen EH, Grote E, Mohler W, Vignery A Cell-cell fusion. FEBS Lett.; 581(11):2181-93, 2007 [ Links ]
25. Vignery A Osteoclasts and giant cells: macrophage-macrophage fusion mechanism. Int J Exp Pathol; 81:291-304, 2000 [ Links ]
26. Cui, Weiguo; Cuartas, Esteban; Ke, Juan; Zhang, Qing; Einarsson, Halldor B; Sedgwick, Jonathon D; Li, Jun; Vignery, Agnes. CD200 and its receptor, CD200R, modulate bone mass via the differentiation of osteoclast. Proct Natl Acad Sci USA 104(36.:14436-41, 2007 [ Links ]
27. Hartgers FC, Vissers JL, Looman MW, van Zoelen C, Huffine C, Figdor CG, Adema G J. DC-STAMP, a novel multimembrane-spanning molecule preferentially expressed by dendritic cells. Eur J Immunol; 30:3585-3590, 2000 [ Links ]
28. Yagi M, Miyamoto T, Sawatani Y, Iwamoto K, Hosogane N, Fujita N, Morita K, Ninomiya K, Suzuki T, Miyamoto K, Oike Y, Takeya M, Toyama Y, Suda T. DC-STAMP is essential for cell-cell fusion in osteoclasts and foreign body giant cells. J Exp Med; 202:345-351, 2005 [ Links ]
29. Yagi M, Miyamoto T, Toyama Y, Suda T. Role of DC-STAMP in cellular fusion of osteoclasts and macrophage giant cells.J Bone Miner Metab;24:355-358, 2006 [ Links ]
30. Kukita T, Wada N, Kukita A, Kakimoto T, Sandra F, Toh K, Nagata K, Iijima T, Horiuchi M, Matsusaki H, Hieshima K, Yoshie O, Nomiyama H. RANKL-induced DC-STAMP is essential for osteoclastogenesis. J Exp Med.; 200:941-946, 2004 [ Links ]
31. Miyamoto T. The dendritic cell-specific transmembrane protein DC-STAMP is essential for osteoclast fusion and osteoclast bone-resorbing activity. Mod Rheumatol; 16(6.:341-2, 2006 [ Links ]
32. Miyamoto T, Ohneda O, Arai F, Iwamoto K, Okada S, Takagi K, Anderson DM, Suda T. Bifurcation of osteoclasts and dendritic cells from common progenitors. Blood; 98:2544-2554, 2001 [ Links ]
33. Servet-Delprat C, Arnaud S, Jurdic P, Nataf S, Grasset MF, Soulas C, Domenget C, Destaing O, Rivollier A, Perret M, Dumontel C, Hanau D, Gilmore GL, Belin MF, Rabourdin-Combe C, Mouchiroud G Flt3+ macrophage precursors commit sequentially to osteoclasts, dendritic cells and microglia. BMC Immunol; 3:15, 2002 [ Links ]
34. Moreno JL, Kaczmarek M, Keegan AD, Tondravi M. IL-4 suppresses osteoclast development and mature osteoclast function by a STAT6-dependent mechanism: Irreversible inhibition of the differentiation program activated by RANKL. Blood; 102:1078-1086, 2003 [ Links ]
35. Alnaeeli M, Penninger JM, Teng YT Immune interactions with CD4+ T cells promote the development of functional osteoclasts from murine CD11c+ dendritic cells. J Immunol; 177:3314-3326, 2006 [ Links ]
36. Rivollier A, Mazzorana M, Tebib J, Piperno M, Aitsiselmi T, Rabourdin-Combe C, Jurdic P, Servet-Delprat C Immature dendritic cell transdifferentiation into osteoclasts: a novel pathway sustained by the rheumatoid arthritis microenvironment. Blood; 104:4029-4037, 2004 [ Links ]
37. Kollet O, Dar A, Shivtiel S, Kalinkovich A, Lapid K, Sztainberg Y, Tesio M, Samstein RM, Goichberg P, Spiegel A, Elson A, Lapidot T. Osteoclasts degrade endosteal components and promote mobilization of hematopoietic progenitor cells Nat Med.;12 (6.:657-664, 2006 [ Links ]
38. Aubin JE Regulation of osteoblast formation and function. Rev Endocr Metab Disord; 2:81-94, 2001 [ Links ]
39. Ducy P, Zhang R, Geoffroy V, Ridall AL, Karsenty G. Osf2/Cbfa1: a transcriptional activator of osteoblast differentiation. Cell; 89:747-754, 1997 [ Links ]
40. Nakashima K, Zhou X, Kunkel G, Zhang Z, Deng JM, Behringer RR, de Crombrugghe B .The novel zinc finger-containing transcription factor osterix is required for osteoblast differentiation and bone formation. Cell; 108:17-29, 2002 [ Links ]
41. Chen G, Deng C, Li Y-P. Tgf-beta and bmp signaling in osteoblast differentiation and bone formation. Int J Biol Sci; 8:272-88, 2012 [ Links ]
42. Derynck R, Akhurst R. Differentiation plasticity regulated by tgf-beta family proteins in development and disease. Nat Cell Biol; 9:1000-4, 2007 [ Links ]
43. Matsunobu T, Torigoe K, Ishikawa M, de Vega S, Kulkarni AB, Iwamoto Y, Yamada Y. Critical roles of the tgf-beta type 1 receptor alk5 in perichondrial formation and function, cartilage integrity, and osteoblast differentiation during growth plate development. Dev Biol; 332:325-38, 2009 [ Links ]
44. Tachi K, Takami M, Sato H, Mochizuki A, Zhao B, Miyamoto Y, Tsukasaki H, Inoue T, Shintani S, Koike T, Honda Y, Suzuki O, Baba K, Kamijo R. Enhancement of bone morphogenetic protein-2-induced ectopic bone formation by transforming growth factor-beta1. Tissue Eng Part A; 17:597-606, 2011 [ Links ]
45. Bennett CN, Longo KA, Wright WS, Suva LJ, Lane TF, Hankenson KD, MacDougald OA.Regulation of osteoblastogenesis and bone mass by Wnt10b. Proc Natl Acad Sci USA 102:3324-3329, 2005 [ Links ]
46. Kubota T, Michigami T, Ozono K. Wnt signaling in bone metabolism. J Bone Miner Metab; 27:265-71, 2009 [ Links ]
47. Nakashima T, Hayashi M, Fukunaga T, Kurata K, Oh-Hora M, Feng JQ, Bonewald LF, Kodama T, Wutz A, Wagner EF, Penninger JM, Takayanagi H. Evidence for osteocyte regulation of bone homeostasis through rankl expression. Nat Med; 17:123-4, 2011 [ Links ]
48. Lin C, Jiang X, Dai Z, Guo X, Weng T, Wang J, Li Y, Feng G, Gao X, He L. Sclerostin mediates bone response to mechanical unloading through antagonizing wnt/beta-catenin signaling.J Bone Miner Res; 24:1651-61, 2009 [ Links ]
49. Li X, Zhang Y, Kang H, Liu W, Liu P, Zhang J, Harris SE, Wu D. Sclerostin binds to lrp5/6 and antagonizes canonical wnt signaling. J Biol Chem; 280:19883-7, 2005 [ Links ]
50. Wijenayaka AR, Kogawa M, Lim HP, Bonewald LF, Findlay DM, Atkins GJ. Sclerostin stimulates osteocyte support of osteoclast activity by a RANKL-dependent pathway. PLoS One 6:e25900, 2011 [ Links ]
51. Chambers TJ, Fuller K. Bone cells predispose bone surfaces to resorption by exposure of mineral to osteoclastic contact. J Cell Sci; 76:155-65, 1985 [ Links ]
52. Hauge EM, Qvesel D, Eriksen EF, Mosekilde L, Melsen F. Cancellous bone remodeling occurs in specialized compartments lined by cells expressing osteoblastic markers. J Bone Miner Res; 16:1575-82, 2001 [ Links ]
53. Sugiyama T, Kohara H, Noda M, Nagasawa T Maintenance of the hematopoietic stem cell pool by CXCL12-CXCR4 chemokine signaling in bone marrow stromal cell niches. Immunity; 25:977-988, 2006 [ Links ]
54. Jung Y, Wang J, Song J, Shiozawa Y, Wang J, Havens A, Wang Z, Sun YX, Emerson SG, Krebsbach PH, Taichman RS Annexin II expressed by osteoblasts and endothelial cells regulates stem cell adhesion, homing, and engraftment following transplantation. Blood; 110:82-90, 2007 [ Links ]
55. Benayahu D, Horowitz M, Zipori D, Wientroub S Hemopoietic functions of marrow-derived osteogenic cells. Calcif Tissue Int; 51:195-201, 1992 [ Links ]
56. Bilbe G, Roberts E, Birch M, Evans DB PCR phenotyping of cytokines, growth factors and their receptors and bone matrix proteins in human osteoblast-like cell lines. Bone; 19:437-445, 1996 [ Links ]
57. Horowitz M, Lorenzo JA Local regualtors of bone: IL-1, TNF, lymphotozin, interferon-?, IL-8, IL-10, IL-4, the LIF/IL-6 family, and additional cytokines. In: Principles of bone biology; Bilezikian JP, Raisz LG, Rodan GA, eds., 2nd ed. New York: Academic Press; 961-977, 2002 [ Links ]
58. Taichman RS, Emerson SG Human osteoblasts support hematopoiesis through the production of granulocyte colony-stimulating factor. J Exp Med; 179:1677-1682, 1994 [ Links ]
59. Alvi LM, Adams GB, Weibrecht KW, Weber JM, Olson DP, Knight MC, Martin RP, Schipani E, Divieti P, Bringhurst FR, Milner LA, Kronenberg HM, Scadden DT Osteoblastic cells regulate the haematopoietic stem cell niche. Nature; 425:841-846, 2003 [ Links ]
60. Visnjic D, Kalajzic Z, Rowe DW, Katavic V, Lorenzo J, Aguila HL Hematopoiesis is severely altered in mice with an induced osteoblast deficiency. Blood; 103:3258-3264, 2004 [ Links ]
61. Ahmed N, Khokher MA, Hassan HT Cytokine-induced expansion of human CD34+ stem/progenitor and CD34+CD41+ early megakaryocytic marrow cells cultured on normal osteoblasts. Stem Cells; 17:92-99, 1999 [ Links ]
62. Shivdasani RA, Fujiwara Y, McDevitt MA, Orkin SH A lineage-selective knockout establishes the critical role of transcription factor GATA-1 in megakaryocyte growth and platelet development. EMBO J; 16:3965-3973, 1997 [ Links ]
63. Shivdasani RA, Rosenblatt MF, Zucker-Franklin D, Jackson CW, Hunt P, Saris CJ, Orkin SH Transcription factor NF-E2 is required for platelet formation independent of the actions of thrombopoietin/MGDF in megakaryocyte development. Cell; 81:695-704, 1995 [ Links ]
64. Kacena MA, Shivdasani RA, Wilson K, Xi Y, Troiano N, Nazarian A, Gundberg CM, Bouxsein ML, Lorenzo JA, Horowitz MC Megakaryocyte-osteoblast interaction revealed in mice deficient in transcription factors GATA-1 and NF-E2. J Bone Miner Res; 19:652-660, 2004 [ Links ]
65. Miao D, Murant S, Scutt N, Genever P, Scutt A Megakaryocyte-bone marrow stromal cell aggregates demonstrate increased colony formation and alkaline phosphatase expression in vitro. Tissue Eng; 10:807-817, 2004 [ Links ]
66. Bord S, Frith E, Ireland DC, Scott MA, Craig JI, Compston JE. Megakaryocytes modulate osteoblast synthesis of type-l collagen, osteoprotegerin, and RANKL. Bone; 36:812-819, 2005 [ Links ]
67. Chagraoui H, Sabri S, Capron C, Villeval JL, Vainchenker W, Wendling F Expression of osteoprotegerin mRNA and protein in murine megakaryocytes. Exp Hematol; 31:1081-1088, 2003 [ Links ]
68. Kartsogiannis V, Zhou H, Horwood NJ, Thomas RJ, Hards DK, Quinn JM, Niforas P, Ng KW, Martin TJ, Gillespie MT Localization of RANKL (receptor activator of NF ?B ligand. mRNA and protein in skeletal and extraskeletal tissues. Bone 25:525-534, 1999 [ Links ]
69. Bord S, Frith E, Ireland DC, Scott MA, Craig JI, Compston JE Synthesis of osteoprotegerin and RANKL by megakaryocytes is modulated by oestrogen. Br J Haematol; 126:244-251, 2004 [ Links ]
70. Calvi LM, Adams GB, Weibrecht W, Weber JM, Olson DP, Knight MC, Martin RP, Schipani E, Divieti P, Bringhurst FR, Milner LA, Kronenberg HM, Scadden DT. Osteoblastic cells regulate the haematopoietic stem cell niche. Nature; 425:841-846, 2003 [ Links ]
71. Zhu, J.; Garrett, R.; Jung, Y.; Zhang, Y.; Kirn, N.; Wang, J.; Joe, G.J.; Hexner, E.; Choi, Y.; Taichman, R.S.; Emerson, S.G Osteoblasts support B-lymphocyte commitment and differentiation from hematopoietic stem cells. Blood; 109:3706-3712, 2007 [ Links ]
72. Joy Y. Wu, Louise E. Purton. Rodda, Min Chen, Lee S. Weinstein, Andrew P. McMahon, David T. Scadden, Henry M. Kronenberg Osteoblastic regulation of B lymphopoiesis is mediated by Gsa-dependent signaling pathways. Proc Natl Acad Sci U S A; 105:16976-16981, 2008
73. Kondo M, Wagers AJ, Manz MG, Prohaska SS, Scherer DC, Beilhack GF, Shizuru JA, Weissman IL. Biology of hematopoietic stem cells and progenitors: Implications for clinical application. Ann Rev Immunol; 21:759-806, 2003 [ Links ]
74. Anderson KL, Smith KA, Pio F, Torbett BE, Maki RA Neutrophils deficient in PU.1 do not terminally differentiate or become functionally competent. Blood; 92:1576-1585, 1998 [ Links ]
75. Tondravi MM, McKercher SR, Anderson K, Erdmann JM, Quiroz M, Maki R, Teitelbaum SL. Osteopetrosis in mice lacking haematopoietic transcription factor PU.1. Nature; 386:81-84, 1997 [ Links ]
76. Scott EW, Fisher RC, Olson MC, Kehrli EW, Simon MC, Singh H. PU.1 functions in a cell autonomous manner to control the differentiation of multipotential lymphoid-myeloid progenitors. Immunity; 6:427-447, 1997 [ Links ]
77. Georgopoulos K. Haematopoietic cell-fate decisions, chromatin regulation and Ikaros. Nat Rev Immunol; 2:162-174, 2002 [ Links ]
78. Cobb BS, Smale ST. Ikaros-family proteins: in search of molecular functions during lymphocytes development. Curr Top Microbiol Immunol; 290:29-47, 2005 [ Links ]
79. Georgopoulos K, Bigby M, Wang JH, Molnar A, Wu P, Winandy S, Sharpe A. The Ikaros gene is required for the development of all lymphoid lineages. Cell; 79:143-156, 1994 [ Links ]
80. Zhuang Y, Jackson A, Pan L, Shen K, Dai M. Regulation of E2A gene expression in B-lymphocyte development. Mol Immunol;40:1165-1177, 2004 [ Links ]
81. Lin H, Grosschedl R. Failure of B-cell differentiation in mice lacking the transcription factor EBF. Nature; 376:263-267, 1995 [ Links ]
82. Hesslein DGT, Fretz JA, Xi Y, Nelson T, Zhou S, Lorenzo JA, Schatz DG and Horowitz M. Ebf1 dependent control of the osteoblast and adipocyte lineages. Bone; 44:53-546, 2009 [ Links ]
83. Urbanek P, Wang Z, Fetka I, Wagner E, Busslinger M. Complete block of early B cell differentiation and altered patterning of the posterior midbrain in mice lacking Pax5/BSAP. Cell; 79:901-912, 1994 [ Links ]
84. Montecino-Rodriguez E, Leathers H, Dorshkind K. Bipotential B-macrophage progenitors are present in adult bone marrow. Nat Immunol; 2:83-88, 2001 [ Links ]
85. Horowitz MC, Xi Y, Pflugh DL, Hesslein DGT, Schatz DG, Lorenzo JA, Bothwell AL. Pax5 deficient mice exhibit early onset osteoporosis with increased osteoclast progenitors. J Immunol; 173:6583-91, 2004 [ Links ]
86. Martin, T.J., N.A. Sims. Osteoclast-derived activity in the coupling of bone formation to resorption. Trends Mol. Med; 11:76-81, 2005 [ Links ]
87. Adams, G.B., D.T. Scadden. The hematopoietic stem cell in its place. Nat. Immunol; 7:333-337, 2006. [ Links ]
88. Nakashima T, Takayanagi H. Osteoimmunology: crosstalk between the immune and bone systems. J Clin Immunol; 29:555-67, 2009 [ Links ]
89. Theill L, Boyle WJ, Penninger JM. Rankl and rank: T cells, bone loss and mammalian evolution. Annu Rev Immunol; 20:795-823, 2002 [ Links ]
90. Wu H, Arron JR. TRAF6, a molecular bridge spanning adaptive immunity, innate immunity and osteoimmunology. Bioessays; 25:1096-1105, 2003 [ Links ]
91. Henderson B, Nair SP. Hard labour: Bacterial infection of the skeleton. Trends Microbiol; 11:570-577, 2003 [ Links ]
92. Zou W, Bar-Shavit Z. Dual modulation of osteoclast differentiation by lipopolysaccharide. J Bone Miner Res; 17:1211-1218, 2002 [ Links ]
93. Akira S, Uematsu S, Takeuchi O. Pathogen recognition and innate immunity. Cell; 124:783-801, 2006 [ Links ]
94. West AP, Koblansky AA, Ghosh S. Recognition and signaling by Toll-like receptors. Annu Rev Cell Dev Biol; 22:409-437, 2006 [ Links ]
95. Josien, R., Wong, B. R., Li, H. L., Steinman, R. M. & Choi, Y. TRANCE, a TNF family member, is differentially expressed on T cell subsets and induces cytokine production in dendritic cells. J. Immunol; 162:2562-2568, 1999 [ Links ]
96. Zaiss, M. M.Sarter K, Hess A, Engelke K,Bohm C,Nimmerjahn F, Voll R, Schett G,David JP Treg cells suppress osteoclast formation: a new link between the immune system and bone. Arthritis Rheum; 56:4104-4112, 2007 [ Links ]
97. Masshak-Rothstein A. Toll-like receptors in systemic autoimmune disease. Nat Rev. Immunol; 6:823-835, 2006 [ Links ]
98. Horwood NJ, Kartsogiannis V, Quinn JM, Romas E, Martin TJ, Gillespie MT Activated T lymphocytes support osteoclast formation in vitro. Biochem. Biophys. Res. Commun; 265:144-150, 1999 [ Links ]
99. Kotake S, Udagawa N, Takahashi N, Matsuzaki K, Itoh K, Ishiyama S, Saito S, Inoue K, Kamatani N, Gillespie MT, Martin TJ, Suda T. IL-17 in synovial fluids from patients with rheumatoid arthritis is a potent stimulator of osteoclastogenesis. J. Clin. Invest; 109:1345-1352, 1999 [ Links ]
100. Walsh MC, KIM M, Kadomo Y, Rho J, Lee SY, Lorenzo J, Choi Y. Osteoimmunology: interplay between the immune system and bone metabolism. Annu Rev Immunol; 24:33-63, 2006 [ Links ]
101. Rifas L, Arackal S, Weitzmann MN. Inflammatory T cells rapidly induce differentiation of human bone marrow stromal cells into mature osteoblasts. J. Cell Biochem; 88:650-59, 2003 [ Links ]
102. Kojiro Sato, Ayaco Suematsu, Kozuo Okando, Akira Yamaguchi, Yasuyugki Morishita, Yuho Kadono, Sakae Tanaka,Tatasuhiko Kodama, Shizuo Akira, Yoichiro Iwakura Daniel j Cua and Hiroshi Takayanagi. Th17 functions on a osteoclastogenic helper T cell subset that links T cell activation and bone destruction. J E M. 203, 12:2673-2682, 2006 [ Links ]
103. Kotake S, Udagawa N, Takahashi N, Matsuzaki K, Itoh K, Ishiyama S, Saito S, Inoue K, Kamatani N,Gillespie MT, Martin TJ, Suda T. IL-17 in synovial fluids from patients with rheumatoid arthritis is a potent stimulator of osteoclastogenesis. J. Clin. Invest; 103:1345-1352,1999 [ Links ]
104. Rho J, Takami M, Choi Y. Osteoimmunology interactions of the immune and skeletal system; Mol Cells 17:1-9, 2004 [ Links ]
105. Abu-Amer Y. IL-4 abrogats osteoclastogenesis through STAT6-dependent inhibition of NF-KappaB. J Clin Invest; 107:1375-1385, 2001 [ Links ]
106. Begtsson AK, Ryan EL. Immune function of the decoy receptor osteoprotegerin. Crit. Rev. Immunol; 22:201-215, 2002 [ Links ]
107. Gilbert L, He X, Farmer P, Boden S, Kozlowski M, Rubin J, Nanes MS. Inhibition of osteoblast differentiation by tumor necrosis factor-alpha. Endocrinology; 141:3956-64, 2000 [ Links ]
108. Smith DD, Gowen M, Mundy GR. Effects of interferon-? and other cytokines on collagen synthesis in fetal rat bone cultures. Endocrinology; 120:2494-99, 1987 [ Links ]
109. Ura K, Morimoto I, Watanabe K, Saito K, Yanagihara N, Eto S. Interleukin (IL.-4 and IL-13 inhibit the differentiation of murine osteoblastic MC3T3-E1 cells. Endocr. J; 47:293-302, 2000 [ Links ]
110. Lewis DB, Liggitt HD, Effmann EL, Motley ST, Teitelbaum SL, Jepsen KJ,Goldstein SA, Bonadio J, Carpenter J, Perimutter RM. Osteoporosis induced in mice by overproduction of interleukin 4. Proct.Natl.Acad.Sci. USA 90:11618-22, 1993 [ Links ]
111. Van Vlasselaer P, Borremans B, Van Der Heuvel R, Van Gorp U, De Waal Malefyt R. Interleukin-10 inhibits the osteogenic activity of mouse bone marrow. Blood; 82:2361-2370, 1993 [ Links ]














