Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista argentina de endocrinología y metabolismo
versión On-line ISSN 1851-3034
Rev. argent. endocrinol. metab. vol.51 no.4 Ciudad Autónoma de Buenos Aires dic. 2014
REVISIÓN
Osteoinmunología: Una visión integrada de los sistemas inmunológico y óseo. Nuevas perspectivas de las enfermedades óseas
Osteoimmunology: An Integrated Vision of Immune and Bone Systems. Novel Perspectives for Bone Disease
Bertini K.1, Drnovsek M.2, Echin M.3, Ercolano M 2, Mingote E.4, Rubin Z.5
1Htal. Militar Central, 2Htal. Ramos Mejía, 3Htal. Rivadavia, 4Htal. César Milstein, 5Htal. de Clínicas Departamento de Metabolismo Mineral y Osteopatías Metabólicas.
Sociedad Argentina de Endocrinología y Metabolismo. CABA
Correspondencia: Zulema S. de Rubin. Servicio de Endocrinología, Hospital de Clínicas José de San Martín, Córdoba 2351. C.P. 1120. CABA. Teléfonos: 4 831-7152, 155 1101405, e-mail: zrubin@fibertel.com.ar
Recibido: 17-09-2014
Aceptado: 06-10-2014
PARTE III
Rol de la inmunología en la pérdida de masa ósea. Una mirada clínica
Osteoimmunology and Bone Loss. A Clinical Overview
RESUMEN
Esta 3ª parte se propone comentar los mecanismos inmunológicos involucrados en el deterioro de la masa ósea en algunas enfermedades autoinmunes. Dado que estas son numerosas (múltiples componentes del Síndrome Poliglandular Autoinmune, Enfermedad celíaca, Síndrome de Crohn, colitis ulcerosa, HIV, patologías reumatológicas, anemia perniciosa, asma bronquial e incluso periodontitis), se eligieron cuatro afecciones que actualmente podrían tener un mayor interés: La Artritis Reumatoidea por ser la patología paradigmática del deterioro óseo; la posmenopausia, donde se describe poco el rol autoinmune; el HIV, por la prolongada sobrevida actual con mayores posibilidades de lesiones óseas y la Periodontitis, como una incursión en el compromiso odontológico, a veces poco conocido por el médico. En muchos casos el conocimiento de estos mecanismos ha contribuido a la generación de medicamentos específicos logrando éxitos terapéuticos con mejor calidad de vida. Rev Argent Endocrinol Metab 51:197-204, 2014
Los autores declaran no poseer conflictos de interés.
Palabras clave: Enfermedades autoinmunes; Deterioro óseo.
ABSTRACT
The objective of this communication is to review the immune mechanisms involved in the pathogenesis of bone damage in some autoimmune diseases. As they are numerous (autoimmune polyendocrinopathy , celiac disease, Crohn's disease, ulcerative colitis, HIV, rheumatic diseases, bronchial asthma, pernicious anemia, periodontitis, etc.), we selected only four: Rheumatoid Arthritis, because of its typical bone lesions; postmenopause, because the immune components are not so often described; HIV, because of the current longer survival time with higher possibilities of bone lesions, and Periodontitis, in order to have an overview of dental aspects of this pathology. In many cases, knowledge of these mechanisms has contributed to the development of specific drugs that have led to therapeutic success and an improved quality of life. Rev Argent Endocrinol Metab 51:197-204, 2014
No finantial conflicts of interest exist.
Key words: Autoimmune diseases; Bone damage.
ABREVIATURAS
RANK: Receptor activador del NFkB
RANK L: Ligando del RANK
IFN: Interferón
OB: Osteoblasto
OC: Osteoclasto
OPG: Osteoprotegerina
IL: Interleukinas
Th: Células T helper
TREG: Células T regulatorias
TNF: Factor de necrosis tumoral
CD40: Proteína coestimuladora de célula presentadora de Ag
CD40L: Ligando de CD40
LB: Linfocitos B
LT: Linfocito T
M-CSF: factor estimulante de colonia de macrófagos
TGF: factor de crecimiento tumoral
CD: Célula dendrítica
AR: Artritis Reumatoidea
PO: Periodontitis
INTRODUCCIÓN
En esta 3ª parte describiremos el rol del mecanismo RANK-RANK L, y asimismo la intervención de otras citokinas como el interferón, las interleukinas producidas por las células T helper(Th), las células TREG, el TNF, las células B y los anticuerpos, en la Artritis Reumatoidea, en la posmenopausia, en el HIV y en la periodontitis. Asimismo las respuestas a algunos tratamientos basados en dichos mecanismos.
OSTEOINMUNOLOGÍA EN ARTRITIS REUMATOIDEA
Hay evidencia acumulada(1,2) de la interacción entre células óseas e inmunológicas, por lo que la fisiología y la patología de un sistema podrían afectar al otro, y es la AR uno de los paradigmas de esta interrelación. La AR está caracterizada por la múltiple y progresiva destrucción articular y como se considera que los linfocitos T juegan un rol predominante en su patogénesis, es importante prestar atención a la destrucción ósea mediada por osteoclastos y la respuesta inmune aberrante, para poder ofrecer estrategias terapéuticas efectivas. Estudios recientes revelan progresos en la comprensión de la interacción de los osteoclastos con los linfocitos osteoclastogénicos T helper 17.
El rol del mecanismo RANK-RANK L. está comprobado y se ha encontrado expresión del RANKL en las sinoviales de los pacientes afectados, mientras que los ratones deficientes en el mismo factor, están protegidos. No se observa erosión en los ratones carentes de C-fos, factor de transcripción esencial para la formación de osteoclastos, que tienen fenotipo de osteopetrosis, aún si están cruzados con ratones transgénicos TNF alfa(3,4) que desarrollan artritis erosiva espontáneamente. En ambos casos el nivel de inflamación es similar por lo que se deduce que ambos factores TNFalfa y RANKL son indispensables para el desarrollo de la lesión articular completa y no solo la inflamación. La infiltración de la sinovial por L T es patognomónica en la AR, y como se sabe que el RANKL está expresado en células T activadas, lo que se debía establecer es si esta fuente de RANKL era capaz de lograr la diferenciación del osteoclasto. Fue demostrada "in vitro" por Kong y col. en 1999(5). Terapias exitosas contra el RANKL fueron comprobadas en modelos animales de artritis. IL 1 y 6 tienen alta capacidad de inducir expresión de RANKL en fibroblastos y osteoblastos sinoviales, facilitando el proceso destructivo y especialmente es importante el TNF-alfa, dado que la terapia contra dicho factor reduce la erosión y la inflamación(6-9).
Pero habría otras citoquinas producidas por las células T como el IFN-gamma, la IL-4, la IL -10, que inhiben la diferenciación del osteoclasto. Por lo tanto, habría que comprobar qué otros factores afectan dicha diferenciación(10,11).
Las células Th1, derivadas de las CD4+T, no estarían ligadas a la destrucción ósea como se pensó en un principio, por la producción de IFN-gamma; las Th2 producen IL-4, IL-5 e IL-10, que contribuyen a la inmunidad humoral. Es necesario mencionar a otro subgrupo celular las Th17, que tendría mayor relevancia en la AR, estimulando la osteoclastogénesis. No producen IFN-alfa, disparan la producción local de citoquinas que inducen la expresión de RANKL en fibroblastos sinoviales y ellas mismas expresan RANKL. Además producen citoquinas proinflamatorias como la IL-17, IL-17F, la IL-21 y la IL-22. La producción de estas células T h17, es inducida por la combinación de IL-6 y TGF-beta. La infiltración de Th17 en la lesión inflamatoria es el nexo entre la respuesta anormal de las células T y la lesión ósea.
Las células TREG(12) CD4+ y CD25 +, están encargadas de la inmunohomeostasis, como se evidencia ante la mutación de su máximo regulador Foxp3, con la producción de severas inmunopatologías. Estas células TREG y las Th17(13) están recíprocamente reguladas durante la diferenciación pero ejercen efectos opuestos en la autoinmunidad. Aparentemente las IL.6 y el TNF-alfa atenúan la función de las TREG. Ha sido comprobado que los cross-laps correlacionan inversamente con las células TREG en sangre periférica en controles y pacientes con AR, pero no habría consenso sobre su acción inhibitoria.
La IL-17 producida por las células Th17, promueve la expresión de muchas citoquinas proinflamatorias y de otros mediadores que contribuyen a la inflamación y erosión de cartílago y hueso en la AR. IL-17 desencadena la activación de NFkB y p38 MAPkinasa en células epiteliales, endoteliales y fibroblastos del estroma. Este efecto se traduce en la secreción de IL-1, TNF, IL-6, IL-8 y prostaglandina E2. Se comprobó que IL-17 se produce espontáneamente en las sinoviales afectadas por AR, siendo un importante estimulador de la osteoclastogénesis. Este efecto es inhibido significativamente por la administración en tejidos sinoviales de un anticuerpo anti-IL-17.
Las células B y los anticuerpos son los responsables de la respuesta inmune humoral. No hay consenso tampoco en sus efectos. El beneficio clínico del tratamiento con Rituximab, el anticuerpo anti-CD20, corroboraría su intervención.
IL-7 es un factor de crecimiento importante para las células B. La administración sistémica de este factor produciría pérdida ósea similar a la de los ratones ooforectomizados.
A través del conocimiento más certero del mecanismo de las Th17 se podrían desarrollar nuevas terapéuticas. Este desarrollo involucra a los receptores nucleares ROR (g y a), cuya presencia se considera trascendente.
Una alternativa exitosa es el anticuerpo anti RANKL, Denosumab, no solo en osteoporosis posmenopáusica: También se mostró efectivo en AR, en un ensayo clínico donde se comprobó menor número de erosiones óseas, después de 6 meses, en los pacientes tratados versus los controles. Otro estudio encontró, asimismo, aumento de la densidad mineral ósea en varias áreas y disminución de los marcadores de resorción(14).
También estaría involucrada la catepsina K, que jugaría un rol importante induciendo la producción de IL-6 e IL-23, y en la producción de inflamación a través de las Th17, por lo cual serviría, asimismo, para la intervención terapéutica.
OSTEOINMUNOLOGÍA EN LA MENOPAUSIA
En mujeres posmenopáusicas hay reducción de la masa ósea y mayor riesgo de fracturas, y la pérdida ósea se produce más rápidamente en los primeros cinco años posmenopausia. Los estrógenos pueden regular la función de OC y OB a través de sus receptores incrementando la actividad anabólica de los OB y deprimiendo la osteoclastogénesis. Estudios recientes han evidenciado que la capacidad de los estrógenos de inhibir la formación de OC solo se da en cocultivos con OB(15).
La deficiencia estrogénica lleva a un aumento de la formación osteoclástica y de la apoptosis osteoblástica. Varios trabajos confirman el rol esencial que cumplen los linfocitos T activos en la pérdida de masa ósea inducida por el déficit estrogénico(16). En la menopausia se describe aumento de la producción de citoquinas por las células T activas. Por el contrario, ha sido demostrado que la hormonoterapia estrogénica en mujeres posmenopáusicas, produce disminución de citoquinas osteoclastogénicas(17,18).
Estudios en ratones ooforectomizados muestran expansión de la población de células T en la médula ósea, asimismo aumento de la producción de citoquinas por las células T activas, principalmente TNF, que se acompaña de incremento de la osteoclastogénesis(16,19). El TNF en forma sinérgica con el RANKL induce la diferenciación de los progenitores hematopoyéticos pluripotenciales de la médula ósea hacia las células del linaje osteoclástico.
El timo regula la salida de linfocitos T al pool periférico y la producción de timocitos a partir de progenitores de la médula ósea. El déficit de estrógenos induce aumento de la liberación de LT desde el timo hacia el pool periférico así como expansión de la población de LT en la médula ósea, pudiendo afectar la osteoclastogénesis en ambas formas: directa o sistémica(20,21).
Frente al déficit estrogénico se produce un estado inflamatorio persistente de bajo grado con liberación de citoquinas como RANK-L , M CSF, TNF, IL 6 y 7, que asimismo aumentan la actividad osteoclastogénica.
Elevaciones del TNF fueron encontradas en ratas ooforectomizadas y en células sanguíneas periféricas en mujeres posmenopáusicas. El TNF induce la producción de RANKL y M-CSF en estroma medular favoreciendo en forma indirecta la osteoclastogénesis(22). Se han encontrado niveles elevados de TNF en estroma medular de ratones ooforectomizados al igual que en un medio condicionado de sangre periférica de mujeres posmenopáusicas(17).
El tratamiento con inhibidores de TNF previno la pérdida ósea inducida por la ooforectomía (23).
IL-6 es una citoquina miembro de la familia gp130, potente estimulador osteoclástico, que se encuentra en las inflamaciones crónicas y ante la deficiencia estrogénica(24). La fuente principal son los OB y las células del estroma medular. Los estrógenos tienen la capacidad de inhibir IL-6 en la línea celular osteoblástica(25,26). El tratamiento con un anticuerpo anti IL-6 previene la pérdida ósea en ratones ooforectomizados(27). El mecanismo de IL-6 sobre el osteoclasto sin embargo sería indirecto. De acuerdo con los estudios de Hattersley y colaboradores, el efecto inductor de la osteoclastogénesis se produciría en cocultivo con OB. El principal efecto de la IL-6 sería a través de la estimulación del osteoblasto, con la producción a partir de éste de RANKL, y como consecuencia la proliferación y activación de los osteoclastos(28-30). La IL-6 también amplifica la acción proosteoclastogénica de IL-1 y TNF.
IL-7 es asimismo una potente citoquina osteoclastogénica , que se presenta ante la deficiencia de estrógenos. Ryan y colaboradores demostraron que el timo, el bazo y la médula ósea son los sitios de tejido linfático productores de IL-7 en estas condiciones. IL-7 aumenta la expresión de RANKL y TNF en las células T. La ooforectomía promueve el desarrollo de células T y este efecto es inhibido parcialmente por anticuerpos anti IL-7(21).
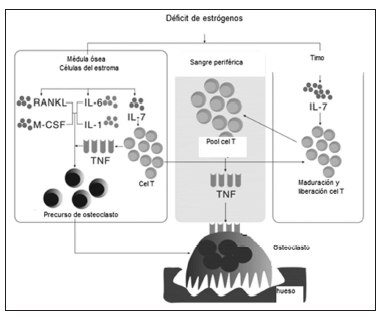
Figura 1. El compromiso inmunológico frente a la deficiencia estrogénica.
OSTEOINMUNOLOGÍA EN HIV
El descubrimiento de la convergencia de mecanismos entre el sistema inmune y la fisiopatología ósea conlleva a actualizar lo que se sabe en una enfermedad tan compleja como la infección por HIV, donde además del grave déficit inmunológico y un estado inflamatorio persistente, se debe considerar la terapéutica ART (antirretroviral), por lo que podemos asumir que la pérdida ósea en esta patología es multifactorial, considerando los clásicos factores de riesgo que se asocian frecuentemente como alcohol, tabaco y consumo de drogas y las patologías concomitantes como pérdida de masa muscular, enfermedad renal, hipovitaminosis D e hipogonadismo. Está claramente establecido que la infección por HIV es un factor de riesgo independiente para osteoporosis u osteopenia, siendo en estos pacientes la probabilidad 3,7 veces mayor para osteoporosis mientras que 2/3 de los mismos tienen osteopenia.
En HIV(31,32) habría una continua estimulación del sistema inmune contribuyendo a una pérdida de células T CD4+ como consecuencia de una activación inducida por muerte celular. Esto se exacerba por la exigua neoformación de células T debido a la disminución de la función del timo. Esto conlleva a una menor respuesta inmune tanto celular como humoral, y a una depleción de células B y T(CD4+ y CD8+), predisponiendo al paciente a complicaciones y a infecciones oportunistas. Hay aumento de células B inmaduras transicionales, asociados a linfopenia de células T CD4+. Los ganglios linfáticos son el sitio principal donde actúa la memoria antigénica específica para las respuestas de las células T y B. En HIV crónica se produce finalmente la fibrosis de los mismos, solo parcialmente revertida por la ART. Por otra parte los individuos infectados presentan una reducción en sangre periférica de las subpoblaciones de células B CD27+ B220.
La terapéutica con ART(33-35) exacerba la pérdida de masa ósea, en los primeros 2 años. Hay estudios que revelan una disminución de la DMO del 2 % al 6 % tanto en cuello de fémur como en columna lumbar, y Triant y col. comunicaron un aumento de la tasa de fracturas 2 a 4 veces tanto en hombres como en mujeres, en edades relativamente jóvenes. En otro trabajo que reunió 39.375 pacientes la tasa de fracturas fue mayor de un 24 a un 32 %.
Ya se ha descripto el rol de citoquinas de origen inmunológico como el TNFalfa, el más reciente SOFAT (secreted osteoclastogenic factor of activated T cells), entre otras, en presencia M-CSF, promoviendo la formación de osteoclastos y de IL-6 a partir de los osteoblastos. Estos, asimismo, intervendrían en la secreción de IL-7 por las células T. También es conocido el rol inmunológico de RANK- RANK L en la regulación y crecimiento de las células T. La función de los linfocitos B es esencialmente humoral, pero serían además, fuente de OPG. En estudios "in vivo" en ratones, se observó que la asociación de CD40L de células T activadas, con su receptor CD40 en células B, potenciaba su secreción de OPG. Esto se confirmó en modelos animales con su deficiencia inmunológica. La deficiencia de CD40L por mutación en el síndrome genético asociado a X Hiper-IGM, presenta elevada tasa de osteopenia y fracturas.
En contraste IL-4 y INF-gamma pueden mediar acciones inhibitorias de la osteoclastogénesis. En HIV, niveles elevados de citoquinas como SOCS-1(supresor of cytokine signaling-1), pueden modificar esta respuesta al impedir la señal de transducción.
Además de estas alteraciones descriptas, la activación inmunológica crónica es un predictor reconocido de progresión de enfermedad. Esto se produce en parte por trastornos de la mucosa gastrointestinal, con alteraciones de la valla microbiana y producción de lipopolisacáridos que son capaces de activar ambos sistemas inmunes: el innato y el adaptativo, y la formación de osteoclastos por aumentar secreción de RANKL, IL-1 y TNFalfa.
Esto fue avalado por estudios en ratas, a las que se les incorporó el genoma viral HIV-1, donde se comprobó severa pérdida de masa ósea y alteraciones de su estructura y arquitectura. Los marcadores de resorción estaban asimismo elevados, había disminución de OPG, con aumento de RANKL y de precursores osteoblásticos. Quizás se podría aseverar entonces que en el HIV hay un impacto disruptivo directo en la interfase inmunoesquelética.
Por otra parte, como hemos dicho al comienzo, ahora habría claras evidencias que ART afecta al hueso en forma independiente de otros factores de riesgo. Es muy complicado reproducir en modelos animales el tratamiento, por la múltiple combinación de drogas. Los resultados de los ensayos clínicos son contradictorios(35).
En un estudio "in vivo" en ratones, con Ritonavir, pero no con Indinavir, habría inhibición de la diferenciación osteoclástica. En otro con NRTIs(inhibidor de la transcriptasa reversa del nucleósido) no hubo efecto sobre osteoclastogénesis pero se suprimió la actividad osteoblástica.
Aunque no hay acuerdo sobre los efectos de ART en células óseas "in vivo", habría un consenso(36-38) general con respecto al efecto perjudicial que producirían todos los tipos de ART, sobre todo dentro de las primeras 48 semanas de instituido el tratamiento, durante la regeneración del sistema inmune (39,40). Además la supresión viral por ART, produce una recuperación parcial de las células T, no solo circulantes sino asimismo una reactivación tímica mediada por IL-7, similar a lo observado en un modelo de osteoporosis inducida por ooforectomía. Aparentemente alterar el delicado equilibrio del sistema inmune produciría per se una ola de mayor resorción ósea y en consecuencia disminución de la densidad. Son necesarios más estudios para corroborar estos mecanismos y evaluar el rol de las diferentes ART.
Es indudable que ART ha prolongado la vida a los pacientes con HIV(40-42), y la mayor tasa de fracturas en personas relativamente jóvenes se incrementará exponencialmente a medida que aumente la edad de los mismos. Pero aunque la pérdida de masa ósea es multifactorial y compleja, estudios recientes sobre el rol de la persistente inflamación crónica, la infección viral y el tratamiento con ART en la interfase inmunoesquelética, abren un amplio espectro de posibilidades para entender sus mecanismos y por ende mejorar la terapéutica a instituir.
Osteoinmunología en periodontitis
La periodontitis (PO)(43) es una lesión inflamatoria de los tejidos periodontales caracterizada por una excesiva resorción del hueso alveolar(44-,47). La presencia de factores derivados de diversas bacterias subgingivales, como por ejemplo lipopolisacáridos, activan ambos sistemas inmunes, el innato y el adquirido, los que producen reacciones inflamatorias locales que conllevan finalmente a la osteoclastogénesis y subsecuente pérdida ósea. Es una de las mayores causas de pérdidas de piezas dentales. Está descripto además que podría asociarse a un aumento de incidencia de ACV e insuficiencia cardíaca.
La severidad de la PO está asociada asimismo a un aumento del ratio RANK -L/OPG. Para determinar la etiología de la enfermedad, linfocitos periféricos de pacientes con PO juvenil localizada fueron transfundidos a ratones Rag 2 -/-, siendo inoculados a continuación con la bacteria Gram negativa Actinobacillus actinomycetam comitans. La PO se manifestó en estos animales, quienes presentaron acumulación de OC en las bolsas alveolares. Se pudo comprobar además que el tratamiento con OPG inhibía la acumulación osteoclástica y el daño óseo(48,49).
En un estudio "in vitro" se demostró que el RANK-L pudo ser inducido en los linfocitos T CD4+ activados por la bacteria antes mencionada y que el efecto se atenuó cuando el cultivo celular fue deplecionado en CD4+. Por lo tanto, podría inferirse que estos linfocitos tendrían una participación importante en la destrucción ósea.
Por otra parte, en un trabajo reciente se examinó la pérdida de hueso alveolar en ratones OPG deficientes (OPG-/-) y en transgénicos para sobreexpresión de RANK-L (RANK-L Tg). La pérdida alveolar fue mayor en los ratones OPG-/-. En estos pero no en RANK-L Tg se evidenciaron pérdidas severas en áreas corticales del hueso alveolar, con mayor acúmulo de OC. La inmunohistoquímica demostró la presencia de OPG en osteocitos pero no en osteoblastos. Hubo abundantes osteocitos OPG+ en el área cortical del hueso alveolar y de huesos largos en los ratones normales y en los RANK-LTg. Esto sugeriría que la OPG producida localmente podría prevenir la resorción ósea en dichas áreas corticales.
Se quiso estudiar la utilidad de los ratones OPG-/- como modelo animal para evaluar drogas que pudieran prevenir la pérdida ósea. Para ello se les administró un anticuerpo anti RANK-L ratón o risedronato, comprobándose en ambos casos una supresión efectiva de la reabsorción ósea(50-54).
CONCLUSIONES
En las patologías autoinmunes, el mejor conocimiento actual del rol de los factores osteoinmunológicos en la patogénesis de las lesiones óseas, ayuda a mejorar el pronóstico y a complementar una terapéutica efectiva.
1. Okamoto K and Takayanagi H. Regulation of bone by the adaptive immune system in arthritis. Arthritis Research & Therapy 13:219-229, 2011 [ Links ]
2. Takayanagi H. Osteoimmunology: shared mechanisms and crosstalk between the immune and bone systems. Nat Rev Immunol 7:292-304, 2007 [ Links ]
3. Suda T, Takahashi N, Udagawa N, Jimi E, Gillespie MT, Martin T. Modulation of osteoclast differentiation and function by the new members of the tumor necrosis factor receptor and ligand families. Endocr Rev 20:345-357, 1999 [ Links ]
4. Yoshida H, Hayashi S, Kunisada T, Ogawa M, Nishikawa S, Okamura H, Suda T, Shultz LD. The murine mutation osteopetrosis is in the coding region of the macrophage colony stimulating factor gene. Nature 345:442-444, 1990 [ Links ]
5. Kong Y Y, Yoshida H, Sarosi I, Tan HL, Timms E, Capparelli C, Morony S, Oliveira dos Santos AJ, Van G, Itie A, Khoo W, Wakeham A, Dunstan CR, Lacey DL, Mak TW, Boyle WJ, Penninger JM. OPGL is a key regulator of osteoclastogénesis, lymphocyte development and lymph-node organogenesis. Nature 397:315-323, 1999 [ Links ]
6. Dougall WC, Glaccum M, Charrier K, Rohrbach K, Brasel K, De Smedt T, Daro E, Smith J, Tometsko ME, Maliszewski CR, Armstrong A, Shen V, Bain S, Cosman D, Anderson D, Morrissey PJ, Peschon JJ, Schuh J. RANK is essential for osteoclast and lymph node development. Genes Dev 13:2412-2424, 1999 [ Links ]
7. Li J, Sarosi I, Yan XQ, Morony S, Capparelli C, Tan HL, Mc Cabe S, Elliott R, Scully S, Van G, Kaufman S, Juan SC, Sun Y, Tarpley J, Martin L, Christensen K, Mc Cabe J, Kostenulk P, Hsu H, Fletcher F, Dunstan CR, Lacey DL, Boyle WJ. RANK is the intrinsic hematopoietic cell surface receptor that controls osteoclastogenesis and regulation of bone mass and calcium metabolism. Proc Natl Acad Sci U S A, 97:1566-1571, 2000 [ Links ]
8. Bucay N, SarosiI, Dunstan CR, Morony S, Tarpley J, Capparelli C, Scully S, Tan HL, Xu W, Lacey DL, Boyle WJ, Simonet WS. Osteoprotegerin deficient mice develop early onset osteoporosis and arterial calcification. Genes Dev 12:1260-1268, 1998 [ Links ]
9. Nakashima T, Takayanagi H. Osteoinmunology: crosstalk between the immune and bone systems. J Clin Immunol 29:555-567, 2009 [ Links ]
10. McInnes IB, Schett G. Cytokines in the pathogenesis of rheumatoid arthritis. Nat Rev Immunol 7:429-442, 2007 [ Links ]
11. Takayanagi H, Iizuka H, Juji T, Nakagawa T, Yamamoto A, Miyazaki T, Koshihara Y, Oda H, Nakamura K, Tanaka S. Involvement of receptor activator of nuclear factor kBligand/ osteoclast differentiation factor in osteoclastogénesis from synoviocytes in rheumatoid arthritis. Arthritis Rheum 2:259-269, 2000 [ Links ]
12. Zaiss M M, Sarter K, Hess A, Engelke K, Bohm C, Nimmerjahn F, Voll R, Schett G, David JP. Treg cells suppress osteoclast formation: a new link between the immune system and bone. Arthritis Rheum 56:4104-4112, 2007 [ Links ]
13. Kojiro Sato, Ayaco Suematsu, Kozuo Okando, Akira Yamaguchi, Yasuyugki Morishita, Yuho Kadono, Sakae Tanaka, Tatasuhico Kodama, Shizuo Akira, Yoichiro Iwakura Daniel J Cua, Hiroshi Takayanagi. Th17 functions on a osteoclastogenic helper T cell subset that links T cell activation and bone destruction. J E M 203, 12:2673-2682, 2006 [ Links ]
14. Kofi A, Mensah MS, Jie Li MS, Schwarz EM. The Emerging Field of Osteoimmunology. NIH Public Access. The Department of Microbiology and Immunology and The Center for Musculoskeletal Research, University of Rochester Medical Center, Rochester, New York. [ Links ]
15. Michael H, Harkonen PL, Vaananen HK. Estrogen and testosterone use different celular pathways to inhibit osteoclastogenesis and bone resorption. J Bone Miner Res 20(12): 2224-2232, 2005 [ Links ]
16. Cenci S, Weitzman MN, Roggia C. Estrogen deficiency induces bone loss by enhancing T-cell production of TNF-alpha. J Clin Invest 106(10):1229-1237, 2000 [ Links ]
17. D'Amelio P, Grimaldi A, Di Bella S. Estrogen deficiency increases osteoclastogénesis up-regulating T cells activity: a key mechanism in osteoporosis. Bone 43(1.:92-100, 2008 [ Links ]
18. Rogers A and Eastell R. The effect of 17beta-estradiol on production of cytokines in cultures of peripheral blood. Bone 29(1):30-34, 2001 [ Links ]
19. Weitzman MN, Roggia C, Toraldo G. Increased production of IL-7 uncouples bone formation from bone resorption during estrogen deficiency. J Clin Invest 110(11):1643-1650, 2002 [ Links ]
20. Goldschneider I. Cyclical mobilization and gated importation of thymocyte progenitors in the adult mouse: evidence for a thymus-bone marrow feedback loop. Immunol Rev 209:58-75, 2006 [ Links ]
21. Ryan MR, Shepherd R, Leavey JK. An IL-7-dependent rebound in thymic T cell output contributes to the bone loss induced by estrogen deficiency. Proc Natl Acad Sci U S A 102(46):16735-16740, 2005 [ Links ]
22. Pacifici R. T cells: critical bone regulators in health and disease. Bone 47(3):461-471, 2010 [ Links ]
23. Kimble RB, Bain S, Pacifici R. The functional block of TNF but not of IL-6 prevents bone loss in ovariectomized mice. J Bone Miner Res 12(6):935-941, 1997 [ Links ]
24. Edwards CJ and Williams E. The role of interleukin-6 in rheumatoid arthritis- associated osteoporosis. Osteoporos Int 21(8):1287-1293, 2010 [ Links ]
25. Girasole G, Jilka RL, Passeri G. 17beta estradiol inhibits interleukin-6 production by bone marrow -derived stromal cells and osteoblasts in vitro: a potential mechanism for the antiosteoporotic effect of estrogens. J Clin Invest 89(3):883-891, 1992 [ Links ]
26. Stein B and Yang MX. Repression of the interleukin-6 promoter by estrogen receptor is mediated by NF-kappa B and C/EBP beta. Mol Cell Biol 15(9):4971-4979, 1995 [ Links ]
27. Jilka RL, Hangoc C, Girasole G. Increased osteoclast development after estrogen loss: mediation by interleukin-6. Science 257(5066):88-91, 1992 [ Links ]
28. Bellido T, Stahl N, Farruggella TJ. Detection of receptors for interleukin-6, interleukin-11, leukemia inhibitory factor, oncostatin M and ciliary neurotrophic factor in bone marrow stromal/osteoblastic cells. J Clin Invest 97(2):431-437, 1996 [ Links ]
29. Kurihara N, Bertolini D, Suda T. Il-6 stimulates osteoclast- like multinucleated cell formation in long term human marrow cultures by inducing Il-1 release. J Immunol 144(11):4226-4230, 1990 [ Links ]
30. Devlin RD, Reddy SV, Savino R. IL-6 mediates the effects of IL-1 or TNF, but not PTHrP or 1-25(OH)2 D3, on osteoclast-like cell formation in normal human bone marrow cultures. J Bone Miner Res 13(3):393-399, 1998 [ Links ]
31. Vikulina T, Fan X, Yamaguchi M. Alterations in the immunoskeletal interface drive bone destruction in HIV-1 transgenic rats. Proc Natl Acad Sci U S A 107(31):13848-13853, 2010 [ Links ]
32. Desai S, Landay A. Early immune senescence in HIV disease. Curr HIV/AIDS Rep 7(1): 4-10, 2010 [ Links ]
33. Brown TT, Qaqish RB. Antiretroviral therapy and the prevalence of osteopenia and osteoporosis: a meta-analytic review. AIDS 20(17):2165-2174, 2006 [ Links ]
34. Bonjoch A, Figueras M, Estany C. High prevalence of and progression to low bone mineral density in HIV-infected patients: a longitudinal cohort study. AIDS 24(18): 2827-2833, 2010 [ Links ]
35. Ofotokun I, Weitzman MN. HIV-1 infection and antiretroviral therapies: risk factors for osteoporosis and bone fracture. Curr Opin Endocrinol Diabetes Obes 17(6):523-529, 2010 [ Links ]
36. Ofotokun I, McIntosh E, Weitzman MN. HIV: Inflammation and Bone. Curr HIV/AIDS Rep 9:16-25, 2012 [ Links ]
37. Brown TT, McComsey GA, King MS, Qaqish RB, Bernstein BM, da Silva BA. Loss of bone mineral density after antiretroviral therapy initiation, independent of antiretroviral regimen. J Acquir Immune Defic Syndr. 51(5):554-561, 2009 [ Links ]
38. Bruera D, Lune N, David DO, Bergoglio LM, Zamudio J. Decreased bone mineral density in HIV-infected patients is independent of antiretroviral therapy. AIDS 17(13):1917-1923, 2003 [ Links ]
39. Gallant JE, Staszewski S, Pozniak AL. Efficacy and safety of tenofovir DF vs. stavudine in combination therapy in antiretroviral -naïve patients: a 3 - year randomized trial. JAMA 292(2):191-201, 2004 [ Links ]
40. Stellbrink HJ, Orkin C, Arribas JR. Comparison of changes in bone density and turnover with abacavir-lamivudine versus tenofovir-emtricitabine in HIV-infected adults: 48- week results from the ASSERT study. Clin Infect Dis 51(8):963-972, 2010 [ Links ]
41. Sharma A, Flom PL, Weedon J, Klein RS. Prospective study of bone mineral density changes in aging men with or at risk for HIV infection. AIDS 24(15): 2337-2345, 2010 [ Links ]
42. Stone B, Dockrell D, Bowman C, Mc Closkey E. HIV and bone disease. Arch Biochem Biophys 503(1.:66-77, 2010 [ Links ]
43. Masanore Koide, Yasuhiro Kobayashi, Tadashi Ninomiya, Midori Nakamura, Hisataka Yasuda, Yoshinori Arai, Nobuo Okahashi, Nobuo Yoshinari, Naoyuki Takahashi, Nobuyuki Udagawa. Osteoprotegerin-Deficient Male Mice as a Model for Severe Alveolar Bone Loss: Comparison with RANKL-Overexpressing Transgenic Male Mice. Endocrinology 154:773-782, 2013 [ Links ]
44. Darveau RP. Periodontitis: a polymicrobial disruption of host homeostasis. Nat Rev Microbiol. 8:481-490, 2010 [ Links ]
45. Nibali L, Donos N, Henderson B. Periodontal infectogenomics. J Med Microbiol 58: 1269-1274, 2009 [ Links ]
46. Cochran DL. Inflammation and bone loss in periodontal disease. J Periodontol 79: 1569-1576 [ Links ]
47. Koide M, Kinugawa S, Takahashi N, Udagawa N. Osteoclastic bone resorption induced by innate immune responses. Periodontol 2000 54:235-246, 2010 [ Links ]
48. Lu HK, Chen YL, Chang HC, Li CL, Kuo MY. Identification of the osteoprotegerin/receptor activator of nuclear factor- kappa B ligand system in gingival crevicular fluid and tissue of patients with chronic periodontitis. J Periodontal Res 41:354-360, 2006 [ Links ]
49. Mogi M, Otogoto J, Ota N, Togari A. Differential expression of RANKL and osteoprotegerin in gingival crevicular fluid of patients with periodontitis. J Dent Res 83:166-169, 2004 [ Links ]
50. Cetinkaya BO, Keles GC, Ayas B, Gurgor P. Effects of risedronate on alveolar bone loss and angiogenesis: a stereologic study in rats. J Periodontol 79:1950-1961, 2008 [ Links ]
51. Jeffcoat MK. Safety of oral bisphosphonates: controlled studies on alveolar bone. Int J Oral Maxillofac Implants 21:349-353, 2006 [ Links ]
52. Rocha ML, Malacara JM, Sanchez-Marin FJ, Vazquez de la Torre CJ, Fajardo ME. Effect of alendronate on periodontal disease in postmenopausal women: a randomized placebo-controlled trial. J Periodontol 75:1579-1585, 2004 [ Links ]
53. Teng YT, Nguyen H, Gao X. Functional human T- cell immunity and osteoprotegerin ligand control alveolar bone destruction in periodontal infection. J Clin Invest 106:R59-R67, 2000 [ Links ]
54. Sheng ZF, Xu K, Ma YL. Zoledronate reverses mandibular bone loss in osteoprotegerin -deficient mice. Osteoporos Int 20:151-159, 2009 [ Links ]














