INTRODUCCIÓN
Considerando que la pérdida de especies a nivel mundial continúa incrementándose como consecuencia de numerosas actividades humanas, diferentes organizaciones realizan periódicamente evaluaciones del estado de conservación y el riesgo de ex- tinción de la biodiversidad global. Entre ellas se destaca la Lista Roja de Especies Amenazadas de la Unión Internacional para la Conservación de las Especies, UICN (Mace et al., 2008; UICN, 2023), reconocida como la fuente más utilizada en temáti- cas relacionadas a la conservación y amenaza de la diversidad biológica en el mundo. Para el desarrollo de las evaluaciones utiliza datos generados por investigadores y especialistas de todo el mundo. Uno de los principales inconvenientes a la hora de evaluar con precisión el riesgo de extinción de las especies está ocasionado por la falta de información detallada para muchos grupos taxonómicos y para ciertas especies en particular (UICN, 2023). En el caso de los hongos, la UICN ha creado recientemente la unidad “The Global Fungal Red List Initiative” (https://redlist.info/ en/iucn/welcome) liderada por un grupo de especialistas en micología de reconocida trayectoria quienes han adecuado los criterios de evaluación generales que aplica la UICN en otras especies para poder ser utilizados en la evaluación de los diferentes grupos de hongos (Dahlberg y Mueller, 2011).
Aplicando estos criterios adaptados, la UICN categorizó a Rickiella edulis (Speg.) Pfister como una especie Amenazada (Endangered) (Calle et al., 2020). Rickiella edulis pertenece a la familia Sarcoscyphaceae (Pezizomycetidae, Ascomycota), cuyas espe- cies se caracterizan por ser saprófitas de la madera y presentar ascomas en forma de copa o disco, que pueden ser sésiles o estipitados. Exhiben una amplia variedad de colores, que van desde tonos marrones y amarillentos hasta colores brillantes, como por ejemplo rojo, anaranjado y amarillo, atribuidos a la presencia de pigmentos ca- rotenoides en sus tejidos; sus ascos son operculados o suboperculados y sus esporas pueden ser lisas o exhibir algún tipo de ornamentación (Sherwood, 1981; Kirk et al., 2008; Ortega-Lopez et al., 2019).
Rickiella edulis había sido registrada entre 1880 y 1922 en Guarapí, Paraguay, considerada como localidad del material tipo (terra typica) de la especie en bosques de la ecorregión del Chaco Húmedo, que hoy se consideran extintos (Spegazzini, 1891, como “Peziza edulis” sp. 132; Romero et al., 2012; Calle et al., 2020). En Brasil, la especie se ha registrado para el Estado de Rio Grande del Sur (Mata Atlántica-Selva Paranaense) en las localidades de: 1-Serro Azul (1928, cuatro colectas), 2-San Leopol- do (1905) y 3-Santa Cruz en 1922 (Pfister, 1987). Adicionalmente, en el año 2020 se presenta un nuevo registro para Brasil en el Estado de San Pablo en una zona de transición entre las ecorregiones de Mata Atlántica y Cerrado (Trierveiler-Pereira et al., 2020). En Argentina, la especie se registró en la provincia de Salta: Yungas Andinas del Sur (Romero et al., 2012); y en la localidad de Oberá, Misiones: Selva Paranaense (Vignale et al., 2015; Grassi et al., 2016). Estos bosques nativos de Argen- tina en los que se registró la especie se encuentran actualmente en retroceso y con procesos de simplificación estructural por la tala indiscriminada para la extracción de maderas de alta calidad, por la actividad agrícola-ganadera y el crecimiento urbano de las ciudades aledañas (Brown y Malizia, 2004; Izquierdo et al., 2008; Gasparri y Grau, 2009; Malizia et al., 2012).
La ecorregión de las Yungas Andinas del Sur (Olson et al., 2001) se ubica en la
porción meridional de los Andes Tropicales y se extiende a lo largo de las laderas occidentales de la cordillera andina (Myers et al., 2000). Conocidas también como ecorregión de Selva de las Yungas en Argentina (Burkart et al., 1999), esta región es reconocida como un punto caliente para la conservación de la biodiversidad ya que alberga el 50% de la diversidad del país, incluyendo una gran cantidad de especies endémicas. En la actualidad sólo un 14% está bajo protección en reservas naturales, provinciales y parques nacionales (Brown et al., 2002; Brown y Malizia, 2004; Brown et al., 2007; Gasparri y Grau, 2006).
El interés por el estudio y análisis de la biodiversidad y su preservación, ha crecido en las últimas décadas, en gran parte como consecuencia de la acelerada tasa de pérdida de hábitats naturales debido a los cambios en el uso de la tierra (Stuart et al., 2010). Las modificaciones del hábitat por actividades humanas operan sobre la biodiversidad no sólo a través de efectos directos como la pérdida de recursos, sino también a través de efectos indirectos como la alteración de interacciones bióticas por la declinación o pérdida de alguna especie funcionalmente vinculada a otra (Nichols et al., 2009). Todos estos factores pueden actuar en forma muy diversa en los diferentes paisajes, pudiendo exacerbarse por efecto del cambio climático y el efecto sobre la diversidad puede, por ende, ser muy variable (Gardner et al., 2007). La concentración de especies y de endemismos de la Selva de las Yungas de Argentina ha sido destacada (Brown et al., 2002). Sin embargo, el marco empírico necesario para fundamentar las amenazas a la conservación de la biodiversidad en zonas modificadas por el hombre en las Selvas de las Yungas es todavía incipiente y muy fragmentado para algunos grupos como los hongos. Numerosos relevamientos en esta ecorregión han incrementado sensiblemente el conocimiento de la diversi- dad de la micota de la Selva de las Yungas (Geml et al., 2014; Nouhra et al., 2018; Niveiro, 2012; Robledo, 2009). Un estudio reciente ha revelado que la comunidad de hongos en las Selvas de las Yungas muestra un fuerte recambio de especies en el gradiente altitudinal (Geml et al., 2014). Sin embargo, los efectos y consecuencias de la actividad humana sobre la diversidad de la comunidad fúngica en estos ambien- tes no han sido estudiados en profundidad. Una dificultad fundamental de muchos estudios referidos a la biodiversidad y su conservación es la limitada comprensión de la diversidad regional restringida a un pequeño número de áreas relativamente prístinas (revisado en Gardner et al., 2007).
La escasa información de base disponible a una escala adecuada, dificulta abor-
dar aspectos fundamentales en la conservación de hongos de las Selvas de las Yungas del noroeste de Argentina. Para poder entender con precisión el grado de influencia sobre la diversidad de especies por la modificación de estos paisajes, resulta impe- rioso incrementar la información sobre la riqueza específica de las comunidades presentes en esta ecorregión. Por ello, los objetivos de este trabajo fueron dar a conocer un nuevo registro de la especie amenazada Rickiella edulis para un sector de la ecorregión de las Selvas de las Yungas en Argentina, y brindar una síntesis de las especies de hongos presentes en Argentina y listadas en el sitio de la Iniciativa Global de la Lista Roja de Hongos de la UICN.
MATERIALES Y MÉTODOS
El listado de especies de hongos y las categorías en las que cada una se incluye fue bajado de la página de la Lista Roja de Especies de la UICN revisadas en la unidad “The Global Fungal Red List Initiative” (https://redlist.info/en/iucn/welcome), para ello se revisó cada una de las especies registradas para Sudamérica. Los gráficos se construyeron en el software R v.4.3.0 y se utilizaron los paquetes packcircles y ggplot2 (R Development Core Team, 2016).
El registro de R. edulis en Jujuy fue en la Reserva de la Biosfera de las Yungas, creada en 2002 por la UNESCO la cual cuenta con una superficie de aproximada- mente 1.350.000 Ha que se distribuyen entre los 300 y los 5000 m snm de altitud (Brown et al., 2007). El gradiente altitudinal favorece la formación de tres pisos alti- tudinales diferenciados por la presencia y dominio de diferentes especies vegetales: Bosque Pedemontano (400-900 m snm) dominado por el palo amarillo [Phyllostylon rhanmnoides (J.Poiss.) Taub.] y el palo blanco [Calycophyllum multiflorum Griseb. (Cas- telo)]; la Selva Montana (900-1600 m snm) definida por la presencia del horco molle (Blepharocalyx salicifolius (Kunth) O.Berg), el laurel (Ocotea porphyria (Griseb.) van der Werff), el cedro (Cedrela angustifolia DC.) y el nogal (Juglans australis Griseb.); y el Bosque Montano (1600-2300 m snm) en la que se observan pinos del cerro (Po- docarpus parlatorei Pilg.), alisos (Alnus acuminata Kunth), y queñoas (Polylepis spp.) (Cabrera, 1971; Malizia et al., 2012).
Rickiella edulis fue registrada en el mes de febrero del 2015 en la Reserva Mu- nicipal de Uso Múltiples Serranías de Zapla (24º14’43,7”S 65º06’48,49”O, 1028 m snm) en el piso altitudinal del Bosque Montano de la ecorregión de las Selvas de las Yungas, provincia de Jujuy, Argentina (Figs. 1A-1B, 1D). Las temperaturas me- dias anuales en esa región varían entre los 14,9 °C y 17,5 °C, y sus precipitaciones medias anuales entre 991 y 1472 mm (Entrocassi Fassinato, 2016). La reserva está conformada principalmente por tierras privadas y se encuentra en un grave estado de vulnerabilidad debido a la creciente deforestación que genera la extracción de madera, pastoreo, caza furtiva, turismo y plantación de especies exóticas (Pinus spp. y Eucalyptus spp.) (Fig. 1C). Sus tierras están incluidas dentro del “Plan de Orde- namiento Territorial de los Bosques Nativos de la Provincia de Jujuy” se encuentra dentro de la Categoría II (amarillo) en la cual se incluyen sectores de mediano a alto valor de conservación, destinadas principalmente a la obtención sustentable de productos forestales madereros y no madereros (Gobierno de Jujuy, 2008).
Los materiales fueron colectados, secados y posteriormente colocados en freezer
por un período de 72 hs. Los estudios macroscópicos se realizaron bajo lupa binocu- lar estereoscópica (Arcano ST30-L). Los estudios de las características microscópicas se realizaron en cortes a mano alzada los que se montaron en hidróxido de potasio (KOH 3%), y reactivo de Melzer y fueron analizados bajo microscopio óptico (Leica DM500). Para determinar los colores de los especímenes se utilizó la carta de colores de Munsell (Munsell Soil Color Charts, 1994). Finalmente, los ejemplares fueron depositados en el herbario del Museo Botánico de Córdoba, de la Universidad Na- cional de Córdoba (CORD).
RESULTADOS
A nivel mundial “The Global Fungal Red List Initiative” ha registrado en su página un total de 1137 especies de hongos liquenizantes y no liquenizantes distribuidos en diferentes grupos (quitridios, zigomicetos, mildiu, hongos de copa, trufas, polveras, royas, entre otras categorías) que se encuentran en diferentes estados de evaluación. Seiscientas dieciocho especies ya han sido efectivamente publicadas; veintiuna es- pecies se han adicionado hasta la fecha desde la revisión de Mueller et al. (2022) la cual incluye datos globales actualizados hasta el 21 de Julio de 2022 (597 especies incluyendo líquenes).
Las 618 especies están distribuidas en las categorías Críticamente Amenazada (CR, 34 especies), Amenazada (EN, 97 especies), Vulnerable (VU, 156 especies), Casi Amenazada (NT, 59 especies), Preocupación Menor (LC, 203 especies) y Datos in suficientes (DD, 69 especies). Para Sudamérica se contabilizan 751 especies de las cuales 477 están en estado de “Propuestas”, 8 se encuentran “sin actividad”, y 265 se encuentran en categorías más avanzadas de evaluación (Fig. 2). De estas 265 especies, 20 de las 47 especies que se observan en “evaluación” corresponden a la Argentina, 19 de las 37 especies que se observan en “evaluación preliminar” corresponden a la Argentina, 8 de las 30 especies que se observan en “en evaluación” corresponden a la Argentina. Se han publicado 151 especies de las cuales 62 (1 liquenizante y 61 no liquenizantes) cuentan con registros en Argentina (Tabla 1), la mayoría de estas especies comparten distribución con países contiguos o son registros cosmopoli- tas, con pocas especies exclusivas o endémicas de Argentina. Respecto a los Phyla Ascomycota y Basidiomycota, se contabilizaron 12 y 50 especies respectivamente, y un conteo de 39 familias, ocho pertenecen a Ascomycota y 31 a Basidiomycota; 18 órdenes, cinco pertenecen a Ascomycota y 12 a Basidiomycota (Fig. 3). En or- den decreciente de riesgo de extinción, las especies se distribuyen en las siguientes categorías de la Lista Roja: Críticamente Amenazada (CR, 6 especies), Amenazada (EN, 3 especies), Vulnerable (VU, 10 especies), No Amenazada (NT, 6 especies), y Preocupación menor (LC, 32 especies). Cuatro especies no reúnen la suficiente información para considerarlas en alguna categoría de amenaza y se incluyen como especies con Datos Insuficientes (DD) (Fig. 4).
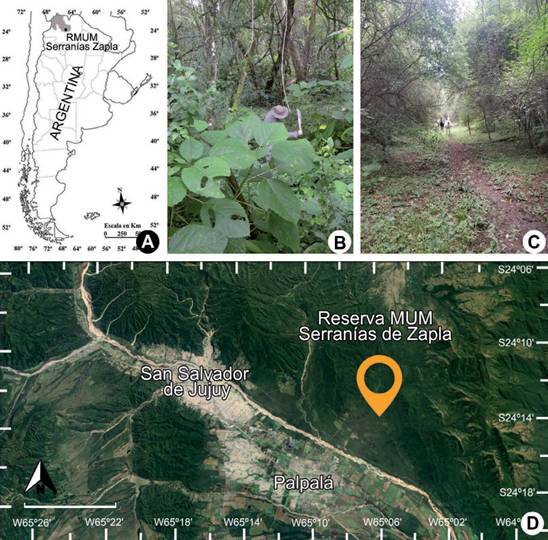
Fig. 1 Ubicación geográfica del sitio de registro de Rickiella edulis. A) Ubicación Reserva Munici- pal de Uso Múltiples Serranías de Zapla en la provincia de Jujuy (GRIS), en el NO de Argentina. B) Reserva Municipal de Uso Múltiples Serranías de Zapla 2015. C) Reserva Municipal de Uso Múltiples Serranías de Zapla en 2023, mostrando desmonte y presencia de ganado. D) Ubicación de la Reserva Municipal de Uso Múltiples Serranías de Zapla (24º14’43,7” S 65º06’48,49” O, 1028 msnm). Barra (D)= 8.000 metros. Fig. 1. Geographical location of the Rickiella edulis record site. A) Location of the Serranías de Zapla Multiple Use Municipal Reserve in the province of Jujuy (GRIS), NW Argentina. B) Serranías de Zapla Multiple-Use Municipal Reserve 2015. C) Serranías de Zapla Multiple Use Municipal Reserve in 2023, showing clearing and presence of livestock. D) Location of the Serranías de Zapla Multiple Use Mu- nicipal Reserve (24º14’43.7“ S 65º06’48.49“ W, 1028 m asl). Bar (D)= 8000 meters.
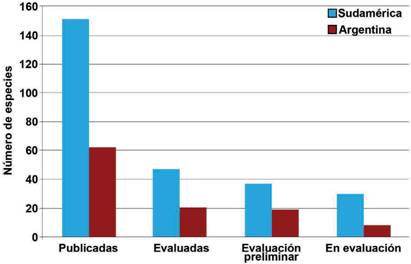
Fig. 2 Número de especies de hongos (liquenizantes y no liquenizantes) registradas en Sudamérica y en Argentina, agrupadas por su estado de evaluación publicado en “The Global Fungal Red List Initiative”. No se incluyen las especies que están en los estados de “Propuestas” y “Sin actividad” por su falta de evaluación. Fig. 2. Number of fungal species (lichenizing and non-lichenizing) recorded in South America and Argentina, grouped by their assessment status published in “The Global Fungal Red List Initiative”. Species in “Proposed” and “Dormant” status are not included due to their lack of assessment.
Entre las 62 especies se destacan ocho especies con distribución cosmopolita que alcanzan una distribución en casi todos los continentes y se encuentran en ca- tegorías de Casi Amenazadas (NT) y Preocupación Menor (LC). Coprinus comatus (O.F. Müll.) Pers. (Dahlberg, 2019a), Montagnea radiosa (Pall.) Šebek (Kałucka, 2019), Poronia punctata (L.) Fr. (Persiani y Ainsworth, 2020), Suillus granulatus (L.) Roussel (Dahlberg, 2019b), S. luteus (L.) Roussel (Dahlberg, 2019c), Lycoperdon perlatum (O.F. Müll.) Pers. (Dahlberg, 2019d), Gastrosporium simplex Mattir. (Berube et al., 2019) y Flavoparmelia caperata (L.) Hale (Allen et al., 2020). Treinta especies cuentan con registros en la región patagónica de Argentina y Chile. Las especies endémicas de Argentina se encuentran en categoría de Vulnerable (VU).
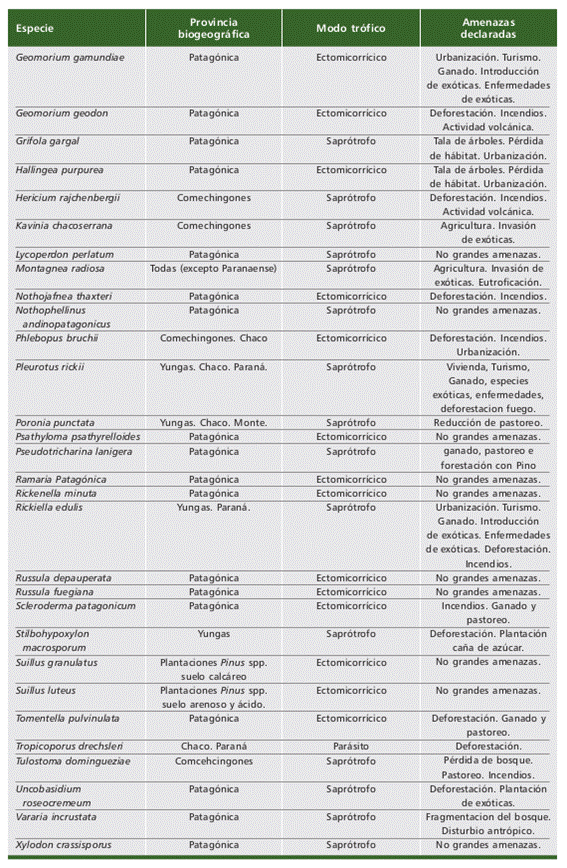
Las principales amenazas que se registran para nuestras 61 especies correspon- den a disturbios antrópicos que involucran la perdida de hábitat o disminución en la calidad de hábitat como son la deforestación, implantación de exóticas, agricultura y ganadería, incendios, urbanización y turismo (Tabla 2). Solo tres especies (Amanita morenoi Raithelh., Amanita nouhrae Truong, Kuhar & M.E. Sm., y Geomorium geodon Kraisit., Pfister, Mujic, Kuhar & M.E. Sm.) mencionan vulcanismo, una actividad natural de formación de corteza terrestre, como una amenaza debido a su área de distribución o hábitat (Parque Nacional Nahuel Huapi, Neuquén). El 72% de las especies publicadas para la Argentina se habitan en la Provincia Biogeográfica Pa- tagónica. Los modos tróficos ectomicorrícico (29 especies) y saprótrofo (27 especies) constituyen el 90% de los registros, restando 5 especies parásitas y 1 especie sim- bionte (la única especie de Ascomycota formadora de liquen).
Tabla 1 (parte 1 de 2). Especies de hongos (liquenizantes y no liquenizantes) registradas en Argen- tina que se encuentran publicadas en “The Global Fungal Red List Initiative” (https://redlist.info/en/ iucn/welcome) y se incluyen en alguna de las categorías de la Lista Roja de la UICN. Abreviaturas de las Categorías UICN: Critically Endangered (CR), Endangered (EN), Vulnerable (VU), Nearly Threatened (NT), Least Concern (LC) y Data Deficient (DD). Table 1 (part 1 of 2). Fungal species (lichenized and non lichenized) recorded in Argentina that are published in “The Global Fungal Red List Initiative” (https://redlist.info/en/iucn/welcome) and are included in one of the IUCN Red List categories. Abbreviations of the IUCN Categories: Critically Endangered (CR), Endangered (EN), Vulnerable (VU), Nearly Threatened (NT), Least Concern (LC) and Data Deficient (DD).
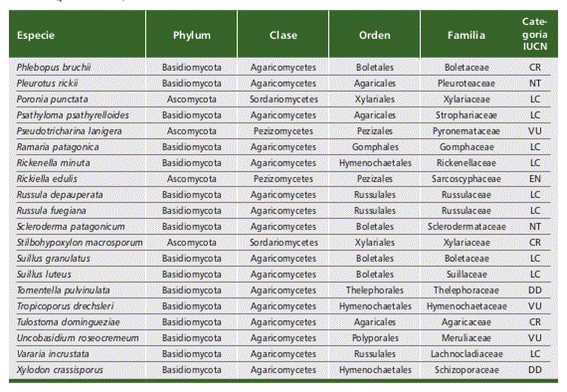
Tabla 1 (2 / 2)
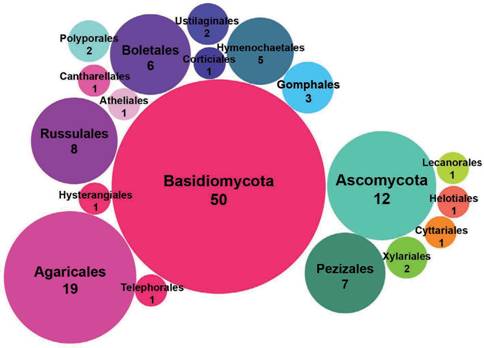
Fig. 3 Número de especies de hongos (liquenizantes y no liquenizantes) registradas en Argentina, separadas por Orden y Phylum, que se encuentran publicadas en “The Global Fungal Red List Initia- tive” y se incluyen en alguna de las categorías de la Lista Roja de la UICN.Fig. 3. Number of fungal species (lichenized and non-lichenized) recorded in Argentina, separated by Order and Phylum, which are published in “The Global Fungal Red List Initiative” and are included in one of the IUCN Red List categories.
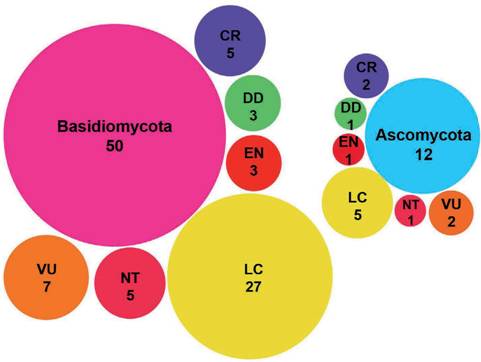
Fig. 4 Número de especies de hongos, liquenizantes y no liquenizantes, registradas en Argentina que se incluyen en las categorías de la Lista Roja de la UICN publicadas en “The Global Fungal Red List Initiative” separadas por Phylum. Abreviaturas y siglas en ingles de las Categorías de la Lista Roja de UICN: Critically Endangered (CR), Endangered (EN), Vulnerable (VU), Nearly Threatened (NT), Least Concern (LC) y Data Deficient (DD).Fig. 4. Number of fungal species (lichenized and non-lichenized) recorded in Argentina that are in- cluded in the IUCN Red List categories published in “The Global Fungal Red List Initiative”, separated by Phylum. Abbreviations and acronyms of the IUCN Red List Categories: Critically Endangered (CR), Endangered (EN), Vulnerable (VU), Nearly Threatened (NT), Least Concern (LC) and Data Deficient (DD).
Tabla 2 (parte 1 de 2). Especies de hongos (liquenizantes y no liquenizantes) registradas en Ar- gentina que se encuentran publicadas en “The Global Fungal Red List Initiative” (https://redlist. info/en/iucn/welcome). Las provincias biogeográficas se mencionan según Arana et al. (2017). Los modos tróficos están acordes a lo publicado en IUCN. Las amenazas declaradas son resumen de lo publicado en UICN. Table 2 (part 1 of 2). Fungal species (lichenized and non-lichenized) recorded in Argentina and pub- lished in “The Global Fungal Red List Initiative” (https://redlist.info/en/iucn/welcome). Biogeographical provinces are mentioned according to Arana et al. (2017). Trophic modes are in accordance with IUCN publications. The declared threats are summarized from the IUCN.
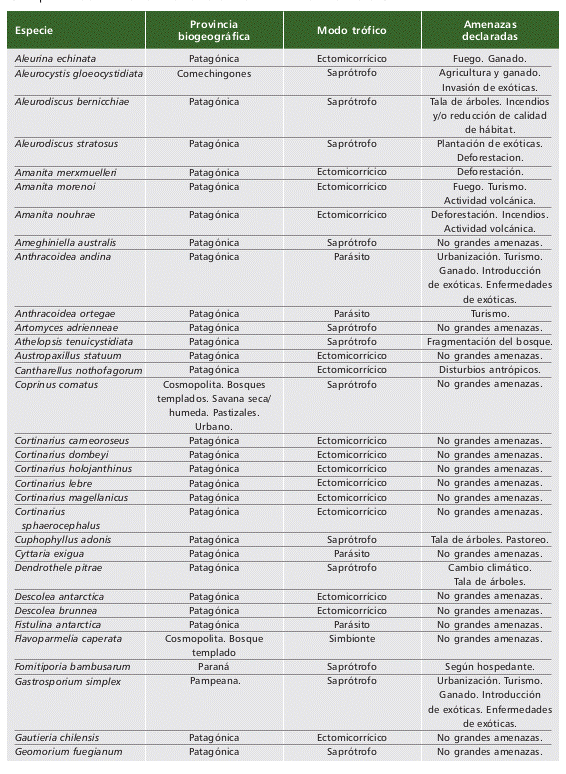
Tabla 2 (2 / 2)
Taxonómicos
Rickiella edulis (Speg.) Pfister, Mycotaxon 29: 330 (1987). Fig. 5.
≡ Peziza edulis Speg., Revista Argent. Hist. Nat. 1(6): 422 (1891).
= Rickiella transiens Syd. & P. Syd. ex Rick, Annls mycol. 2(3): 244 (1904).
Ascomas 2-30 mm de diam. × 1-20 mm alt., convexo, pulvinado, estipitado a sub- estipitado (Figs. 2A-2C). Superficie himenial lisa, marrón claro (HUE7.5YR 8/4 pink - 8/6 redish yellow) en estado fresco (Fig. 5C) y marrón anaranjado (HUE 7.5YR 7/8-6/8 redish yellow) en estado seco, presenta un marcado retículo oscuro que corresponde al contacto del himenio con el excípulo y al himenio mismo (Fig. 5D). Excípulo blanco crema (HUE 7.5YR 8/1 white) tornándose marrón pálido al secarse (HUE 10YR 7/4 very pale brown), formado por cavidades y cámaras que le dan un aspecto esponjoso, el tamaño de las cámaras disminuye conforme se acercan al himenio (Figs. 5B, 5D). Ascos cilíndricos, hialinos, operculados, octosporados, hasta 350 μm de longitud x 15-17 μm de diám., pared de 3 μm de espesor (Figs. 5E-5F). Paráfisis hialinas, 3-4 μm de diámetro, ápice romo (Fig. 5E). Ascosporas elipsoidales, hialinas, bigutuladas, lisas, pared de 1 μm de espesor, 19-22 μm long.
× 10-14 μm diám. (Figs. 5E-5F).
Material estudiado.- ARGENTINA. Prov. Jujuy. Dpto. Palpalá: Reserva Munici- pal de Uso Múltiples Serranías de Zapla, 24º14’43,7”S 65º06’48,49”O; 1028 msnm, 11-II-2015, Vaira M., Hernández Caffot M.L. 2238 (CORD).
Hábitat.- Sobre ramas caídas en el interior de bosque con buena cobertura arbórea y presencia de sustrato arbustivo y herbáceo, área de Bosque Montano con planta- ciones de Eucalyptus spp. La colección incluye un ascoma de gran tamaño (30×20 mm) y nueve ascomas juveniles de tamaño menor igualmente maduros.
Distribución geográfica.- ARGENTINA. Jujuy. Departamento Palpalá. Reserva Municipal de Uso Múltiples Serranías de Zapla. Salta. La Caldera. Camino de tierra que une Ruta 9 (Camino de Cornisa) con General Güemes. Misiones, Oberá. Muni- cipio de Campo Ramón. BRASIL. Rio Grande del Sur, Serro Azul, San Leopoldo y Santa Cruz; San Pablo, Angatuba. Barrio Guareí Velho, bosque ribereño del río Guareí. PARAGUAY. Guarapí. Departamento Paraguarí (localidad del tipo).
DISCUSIÓN
A nivel local se puede observar que las especies efectivamente publicadas en la UICN corresponden a los phyla Ascomycota y Basidiomycota (Tabla 1) y que estos datos coinciden con lo observado a nivel mundial por Mueller et al. (2022) cuya investi- gación menciona el hecho de que todas las especies corresponden a macrohongos liquenizantes y no liquenizantes de ambos phyla lo cual constituye un gap en lo que se refiere a aportes a la lista roja de hongos. Sin embargo en las categorías previas a ser efectivamente publicadas en la UICN (propuestas e inactivas) para Argentina se observan numerosas especies de Glomeromycota, de Zygomycota y dentro de Protozoa los actuales Myxogastrea. Si bien actualmente no hay especies publicadas de otros phyla, se espera que en los próximos años con la actualización de las eva- luaciones de la UICN se incorporen estas especies que están en espera. Actualmente el 41% de las especies publicadas para Sudamérica corresponden a la Argentina y en las categorías inferiores, las especies que están propuestas y que van avanzando en su categoría de evaluación, se puede observar el advenimiento de grandes aportes a nuestra funga argentina.

Fig. 5 Ejemplares de Rickiella edulis registrados en la Reserva Municipal de Uso Múltiples Serranías de Zapla, Jujuy, NO Argentina. A) Hallazgo de R. edulis. B) Ascomas jóvenes de R. edulis. C) Espécimen maduro de R. edulis, se observa la superficie himenial ya convexa. D) corte por himenio, se obser- van ascos maduros e inmaduros con ascosporas, y paráfisis. E) Ascos con ascosporas, ascosporas bigutuladas. Barras (E-F): 20 μm. Vaira y Hernández Caffot 2238 (CORD). Fig. 5. Rickiella edulis specimens recorded at the Serranías de Zapla Municipal Multiple Use Reserve, Jujuy, NW Argentina. A) Findings of R. edulis. B) Young ascomata of R. edulis. C) Mature specimen of R. edulis, hymenial surface already convex. D) Hymenial slice, showing mature and immature asci with ascospores and paraphyses. E) Asci with ascospores, bi-gutulate ascospores. Bars (E-F): 20 μm. Vaira and Hernández Caffot 2238 (CORD).
En la Argentina se registran 62 especies de hongos evaluadas en alguna de las categorías de riesgo de extinción de la Lista Roja de UICN incluyendo a R. edulis. Si tenemos en cuenta la gran diversidad de especies de hongos registradas para la Argentina y las problemáticas ambientales que afectan seriamente la biodiversidad local, el número de especies de Argentina evaluadas por sus riesgos de extinción puede considerarse bajo. La cantidad de especies de los phyla Ascomycota y Basi- diomycota publicados en la Lista Roja de la UICN muestran una marcada asimetría en favor de Basidiomycota casi cuadriplicando el número de especies de Ascomycota. Las contribuciones de categorización de especies a “The Global Fungal Red List Initiative” pueden ser realizadas por especialistas de cada grupo taxonómico durante todo el año. Por lo que la asimetría detectada podría deberse a la falta de especialistas en Ascomycota en los grupos de micología del país o a una menor participación de los mismos en la evaluación del riesgo de extinción de las especies que conforman ese Phylum.
Las especies con distribución cosmopolita están asociadas principalmente a
ambientes con fuertes disturbios o cambios en el uso de la tierra producidos por el hombre (deforestación, introducción de ganado, urbanización, entre otros). Algunas de ellas, como es el caso de Coprinus comatus y Montagnea radiosa, además están filo- genéticamente emparentadas y presentan caracteres morfológicos similares (Hople y Vilgalys, 1994). Poronia punctata es una especie que si bien la UICN la clasifica entre las especies de Preocupación menor (Persiani y Ainsworth, 2020), en Europa se ha reportado su extinción en numerosos países y actualmente está incluida en el Plan de Acción para la Biodiversidad del Reino Unido (UK BAP, http://www.ukbap. org.uk/) y en el Programa de Recuperación de Especies de English Nature (English Nature’s Species Recovery Programme) (Matočec, 2000; Venturella y Saitta, 2009). Suillus granulatus y S. luteus, ambas presentan una amplia distribución mundial ya que han sido introducidas junto a las numerosas especies de coníferas (Pinus spp.) que son ampliamente utilizadas en la industria de la madera.
Finalmente, dentro de las especies con distribución cosmopolita, existe un registro que resulta controversial: Flavoparmelia caperata, un liquen epífito. Como muchos líquenes F. caperata presenta compuestos antibacteriales, antimicóticos y antitumorales en su talo (por ejemplo: Dieu et al., 2020; Mendili et al., 2021; Rashmi y Rajkumar, 2015) y además presenta una actinobacteria asociada a su talo Streptomyces albidoflavus (G.A. de Vries & Kleine-Natrop) G.M. Muell. (Streptomy- cetaceae, Actinomycetales) la cual entre sus metabolitos secundarios y compuestos bioactivos también produce compuestos antibacteriales, antifúngicos y antitumorales que además le confiere protección ante las condiciones climáticas actuales de altas temperaturas (Sarmiento-Vizcaíno et al., 2016). Si bien su distribución es cosmopolita y los trabajos que la incluyen mencionan una gran abundancia de sus talos en las diferentes regiones; su potencial para uso medicinal y su actual nivel de aplicación en actividades de experimentación debería ser considerada como un presión para la especie en su próxima reevaluación de la UICN por la excesiva extracción de talos que podría generar en sus hábitats naturales.
Los registros patagónicos Argentina-Chile, corresponden a especies que se de- sarrollan en bosques de lenga (Nothofagus spp., Blume). Sus especies se distribuyen en latitudes tropicales y templadas y han sido cruciales para explicar la secuencia de ruptura de Gondwana Oriental (Swenson et al., 2001), y con ello se explica en parte la gran diversidad de funga compartida en estos ecosistemas comunes a am- bos países. Se explica además la presencia en Patagonia de especies que existen en Nueva Zelanda como es el caso de Cortinarius magellanicus Speg. (Furci et al., 2020) o de Uncobasidium roseocremeum Gorjón, Gresl. & Rajchenb presente en Bosques Valdivianos asociado a su único hospedador Saxegothaea conspicua Lindl. (Greslebin et al., 2020; Arana et al., 2021).
Las especies de distribución restringida son endémicas y están vinculadas a formaciones boscosas específicas como Tulostoma domingueziae Hern. Caffot, asociada a bosques de tabaquillo (Polylepis australis Bitter) de las Sierras Grandes de Córdoba (Hernández Caffot et al., 2011; Kuhar et al., 2020), Scleroderma patagonicum Nouhra & Hern. Caff., asociada a especies de Nothofagus (Nouhra et al., 2012; Smith, 2020), o Wrightoporia araucariae Westph. & Reck asociado a Auraucaria angustifolia (Bertol.) Kuntze, que se distribuye en el Noreste de Argentina (Robledo et al., 2020; Westpha- len et al., 2014). Además se encuentran algunas especies de distribución más amplia como Stilbohypoxylon macrosporum Hladki & A.I. Romero, cuyos ascomas se pueden encontrar en toda la región austral de la Selva de las Yungas (Hladki y Romero, 2003; Kuhar et al., 2020).
Resulta de suma importancia destacar el estado de conservación de la especie comestible Butyriboletus loyo (Phillippi) Mikšík, micorrícica asociada a bosques de No- thofagus; esta especie cuenta con numerosos registros en Chile (Furci, 2019). Ha sido citada para el Parque Nacional Nahuel Huapi (provincia de Neuquén) por Spegazzini en el año 1912 (como Boletus loyo Phillippi) y no se ha registrado desde entonces. Consideramos que esta falta de información local podría deberse quizás a diferentes motivos: la falta de relevamientos en las localidades históricas, la intermitencia de la especie por sus características ecológicas o a cambios drásticos de las condiciones climáticas en la región, o finalmente, a la desaparición de las poblaciones argentinas por sobreexplotación del recurso. Es de suma importancia incrementar los esfuerzos para así contribuir con datos de su existencia o ausencia en el territorio.
El presente trabajo contribuye con nueva información respecto a la distribución geográfica de Rickiella edulis en la Argentina. Los rasgos morfológicos de R. edulis la convierten en una especie de fácil distinción e identificación a campo y si consi- deramos el extenso trabajo de campo que realizamos los micólogos en las diferentes ecorregiones del país, sus registros son escasos. Por tanto, resulta llamativo que los últimos dos registros de la especie en Argentina datan ambos del año 2015, uno en Selva Paranaense, Misiones (Vignale et al., 2015; Grassi et al., 2016) y el segundo en Reserva Biósfera de las Yungas, en Jujuy (presente trabajo). Para este trabajo en particular se han repetido numerosas incursiones al sitio puntual de hallazgo y sus alrededores en la Reserva Municipal de Uso Múltiples Serranías de Zapla en los años consecutivos al 2015, y se tuvo también en cuenta realizar los muestreos en el mismo mes de hallazgo y en los meses anteriores y posteriores, sin tener éxito en registrar nuevamente a R. edulis en la Reserva. Es posible que la aparición de sus ascomas se relacione con condiciones climáticas específicas de ese año o simplemente a la intermitencia en la producción de ascomas que caracteriza a los hongos en general y que se sostiene debido a la fiabilidad con la que ascomas y basidiomas emergen en los mismos sitios de hallazgo año tras año con mayor certeza en la época estival, en determinadas estaciones según el hemisferio en el que se trabaja, el grupo de hongos al que pertenezca, o según la especie (Kirk et al., 2008; Mueller et al., 2004; Jimé- nez Nieva et al., 2022). Su categorización dentro de amenazada (EN - endangered) corresponde a C2 - a (ii), lo cual indica que se trata de una población de pequeño tamaño y en declinamiento continuo, con un gran número de individuos maduros concentrados en una subpoblación (Dahlberg y Mueller, 2011). La adición de este material al registro de la especie quizás es relevante para una futura evaluación de la especie por parte los miembros de la UICN ya que su población, definida como número de individuos maduros capaces de reproducirse se ha incrementado y además la colección se ha encontrado hacia el Norte del primer registro de R. edulis en el país (Romero et al., 2012), siguiendo dentro del ecosistema de Yungas, dejando abierta la hipótesis de que la especie alcance distribuciones quizás más boreales dentro del mismo ecosistema.
La situación ambiental en la que se encuentran la Selva de las Yungas en Argen-
tina es preocupante y pone en serio riesgo la supervivencia de muchas especies. Las áreas protegidas en la Selva de Yungas alcanzan solamente al 14% de su extensión con amplias áreas sometidas a explotación productiva y la expansión urbana con el consecuente riesgo de declinación de muchas de las especies de hongos registradas. Entonces resulta de gran importancia publicar estos hallazgos de especies poco fre- cuentes en la región contribuyendo de esta manera a incrementar el conocimiento sobre su distribución y los riesgos que enfrentan. Quizás mayores esfuerzos destina- dos a evaluar el estado de conservación de la funga argentina y su clasificación en las categorías de la Lista Roja de la UICN pueda contribuir a sumar más argumentos que justifiquen el incremento en los porcentajes de bosques incluidos en áreas pro- tegidas , a impulsar la creación de nuevas áreas protegidas o a revalorizar superficies de bosques que se encuentran incluidas en categorías menores de los planes de or- denamiento territorial propiciando el cambio a una categoría de protección mayor donde se realicen manejos sustentables de estos bosques.