Introducción
Los tumores cerebrales (TC) constituyen alrededor del 25% de las neoplasias en niños y jóvenes, y aproximadamente la mitad de estos tumores surgen en la fosa posterior, con una tasa de incidencia aproximada de 5,13 casos por cada 100.000 niños.1 El síndrome de fosa posterior (SFP) es una consecuencia de la cirugía de fosa posterior. Fue descripto originalmente en 1979 en niños con meduloblastoma.2
El tumor de fosa posterior (TFP) representa entre el 50-70% de los tumores cerebrales de la infancia en comparación al 15-20% en adultos.3,4 El Registro Oncopediátrico Hospitalario Argentino informó que entre el 2000 y 2019 la incidencia de tumores del sistema nervioso central en niños <14 años fue de 19%.5 La fosa posterior es la localización más habitual3, y en nuestro país, los tumores más frecuentes son el meduloblastoma, el astrocitoma y el ependimoma.5
El tratamiento propuesto en la literatura implica la resección quirúrgica, sola o en combinación con tratamientos coadyuvantes, como la radioterapia y quimioterapia.6
Luego de la cirugía de resección, la tasa de SFP es variable, pero los informes sugieren que lo presentan entre el 20-30% de los niños sometidos a cirugía de la fosa posterior.7 Suele aparecer entre 1 y 6 días después de la cirugía y es caracterizado por afectar áreas motoras (p. ej., ataxia, dismetría, adiadococinesia, nistagmus), neuroconductuales (p. ej., el síndrome cognitivo afectivo cerebeloso, que incluye irritabilidad, apatía, problemas de atención y memoria) y lingüísticas (p. ej., disartria, mutismo).8
La ataxia cerebelosa es el trastorno postural más característico del SFP, que provoca alteración del equilibrio, incremento de caídas y disminución de habilidades funcionales.3 Para evaluar la ataxia, una de las escalas de valoración más utilizadas es la escala para la evaluación y calificación de la ataxia (SARA, por sus siglas en inglés).9 La ataxia y otras afecciones que caracterizan al SFP pueden conllevar a un compromiso en la movilidad funcional. La movilidad funcional es la forma en que los niños se mueven realmente en su entorno y se puede medir utilizando la escala de movilidad funcional (FMS, por sus siglas en inglés).10
Conocer los resultados funcionales de los sujetos según el tipo de tumor, la extensión y las áreas afectadas puede ayudarnos a entender cuáles serán las características clínicas de dichos pacientes para poder plantearnos un abordaje específico. Por lo tanto, el objetivo de este estudio fue describir el abordaje médico y la recuperación funcional de tres niños con síndrome de fosa posterior en una clínica de rehabilitación de Buenos Aires.
Presentación de los casos
Se analizaron tres niños que presentaron SFP dentro de los 30 días postquirúrgicos del TFP y que contaron con evaluaciones completas. Las características específicas de cada paciente se encuentran en la Tabla 1. Fueron dos pacientes de sexo masculino y una de sexo femenino (entre 5 y 15 años) que recibieron evaluación, tratamiento y seguimiento por los servicios de neurooncología y kinesiología del centro de rehabilitación infantil de Fleni, sede Escobar (aprobación CEI, protocolo #10/22). Los familiares de los niños firmaron el consentimiento informado y aceptaron utilizar su información para la publicación del trabajo. En la Figura 1, se presenta la línea de tiempo con los eventos más relevantes de los 3 casos.
Tabla 1 Características de los sujetos.
| Variables | Caso 1 | Caso 2 | Caso 3 |
|---|---|---|---|
| Sexo | Masculino | Masculino | Femenino |
| Edad, años | 5 | 6 | 15 |
| Tipo de tumor | Meduloblastoma | Meduloblastoma | Astrocitoma |
| Subtipo histológico | Clásico (WNT) | Anaplásico (IV) | Pilocítico |
| Estadío | Localizado | Metastásico | Localizado |
| Síndrome de fosa posterior | Sí | Sí | Sí |
| Nistagmus | Sí | Sí | Sí |
| Hidrocefalia | Sí | Sí | Sí |
| Válvula | Sí | Sí | No |
| Radioterapia | Sí | Sí | No |
| Quimioterapia | Sí | Sí | No |
| Semanas desde Cx a Rh | 1 | 3 | 4 |
| Medicación | Hormonal | - | Hormonal |
Cx: cirugía; Rh: rehabilitación.
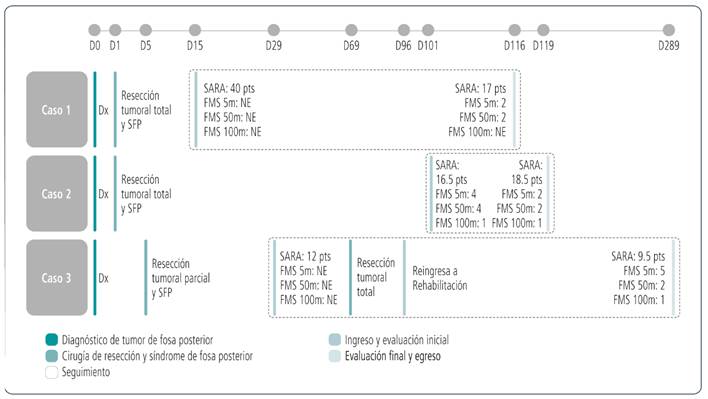
D: día; Dx: diagnóstico; SFP: síndrome de fosa posterior; SARA: escala para la evaluación y calificación de la ataxia; FMS: escala de movilidad funcional; NE: no evaluable.
Figura 1 Línea de tiempo con los eventos más relevantes.
Estudio de imágenes
Se realizaron resonancias magnéticas (RM) en equipo 3T (Discovery MR750, GE Medical Systems) con evaluación preoperatoria, postoperatoria y nuevo control luego de finalizada la rehabilitación. En todos los casos, se efectuaron secuencias FLAIR 3D (Cube), registros 2D axiales ponderados en T2, secuencia de difusión (DWI) con correspondiente mapa de ADC y registros T1 FSPGR 3D antes y después de la administración de gadolinio. Los estudios se analizaron para su comparación y para la evaluación del grado de resección, del grado de extensión de la secuela postoperatoria y de la presencia de posibles complicaciones isquémicas o hemorrágicas postquirúrgicas.
Evaluación clínica
Se evaluó clínicamente la presencia de adiadococinesia, dismetría, temblor y ataxia a partir de los resultados obtenidos de la administración de la SARA. Esta escala otorga un puntaje total de 0 (sin ataxia) a 40 (máximo grado de ataxia) y está compuesta por 8 ítems.11,12 La presencia de adiadococinesia, dismetría y temblor se definió por un puntaje ≥1 en los ítems movimientos rápidos y alternados, señalamiento con el dedo y prueba índice-nariz.
Movilidad funcional
La evaluación de la movilidad funcional se determinó mediante la FMS, que valora el medio por el cual un individuo se moviliza dentro del entorno para alcanzar la interacción con la familia y la sociedad.13,14 Esta herramienta evalúa la capacidad, el desempeño y el requerimiento de asistencia para caminar en tres distancias específicas: hogar (5 m), escuela (50 m) y comunidad (500 m). En cada una de las tres distancias, se asigna un puntaje de 1 (uso de silla de ruedas) a 6 (independientes en todas las superficies). En caso de incapacidad para autopropulsar la silla de ruedas, se indica “N” (no aplicable).13,14
Rehabilitación
Con el objetivo de lograr el mayor grado de independencia funcional posible para las actividades funcionales y de la vida diaria, se trabajó facilitando la activación de la musculatura postural profunda, el fortalecimiento muscular analítico y funcional, el entrenamiento de la capacidad aeróbica y la reeducación del equilibrio y de la marcha.15 En cuanto a la dosificación, se realizaron dos sesiones diarias con una duración de aproximadamente 30 minutos cada una. Las sesiones se realizaron en ambientes protegidos (p. ej., el gimnasio de rehabilitación y habitaciones) y comunitarios (p. ej., pasillos y espacios de circulación), según los diferentes propósitos terapéuticos.
Caso 1
Consultó por reagudización y aumento de intensidad de la cefalea en el último mes. En la RM de cerebro, se evidenció lesión ocupante de espacio en fosa posterior, de ubicación en línea media (localización vermiana), en proyección del IV ventrículo con discreta dilatación del sistema ventricular supra-tentorial. Fue sometido a amplia resección tumoral, y en las imágenes postquirúrgicas ponderadas en T2, se observó gliosis de la cavidad quirúrgica con retracción parenquimatosa, amplia resección de núcleos dentados y lesiones isquémicas alrededor del lecho quirúrgico. Realizó radioterapia craneoespinal de intensidad modulada (IMRT, por sus siglas en inglés) a 24 Gy con boost de 56 Gy en lecho, junto con 6 ciclos de tratamiento quimioterápico con vincristina, cisplatino y ciclofosfamida. Luego de la cirugía, intercurrió con SFP y, una vez estable clínicamente, fue internado para iniciar rehabilitación de signos y síntomas de SFP.
Al ingreso, el cuadro motor se comportaba como una cuadriparesia atáxica a predominio derecho con presencia de adiadococinesia, temblor, dismetría, mutismo, inestabilidad emocional, irritabilidad y disfagia (nutrición enteral por sonda nasogástrica). Al administrar la SARA, se constató el máximo grado de ataxia con 40 puntos (Tabla 2). Presentaba mayor compromiso a nivel axial y ausencia de control cefálico y tronco. A nivel distal, la movilidad voluntaria se encontraba preservada, aunque incoordinada y dismétrica. En cuanto a la movilidad funcional según la FMS, era usuario de silla de ruedas, pero con incapacidad para autopropulsarse en las 3 distancias evaluadas (Figura 2).
Tabla 2 Valores en la SARA.
| Variables | Caso 1 | Caso 2 | Caso 3 | |||||
|---|---|---|---|---|---|---|---|---|
| Ingreso | Egreso | Ingreso | Egreso | Ingreso | Egreso | |||
| Marcha | 8 | 6 | 5 | 4 | 2 | 1 | ||
| Bipedestación | 6 | 4 | 4 | 3 | 2 | 2 | ||
| Sedestación | 4 | 0 | 0 | 0 | 2 | 1 | ||
| Habla | 6 | 1 | 0 | 0 | 0 | 0 | ||
| Señalamiento con el dedo | 4/4 | 1/1 | 1/2 | 1/2 | 0/3 | 0/2 | ||
| Prueba índice-nariz | 4/4 | 1/1 | 1/2 | 1/2 | 0/3 | 0/3 | ||
| Diadococinesia | 4/4 | 3/3 | 3/3 | 3/3 | 0/3 | 0/3 | ||
| Prueba talón-rodilla | 4/4 | 1/1 | 1/2 | 1/2 | 0/3 | 0/3 | ||
| Total | 40 | 17 | 16,5 | 14,5 | 12 | 9,5 | ||
n/n: indica los valores registrados para el lado izquierdo y derecho; SARA: escala para la evaluación y calificación de la ataxia.
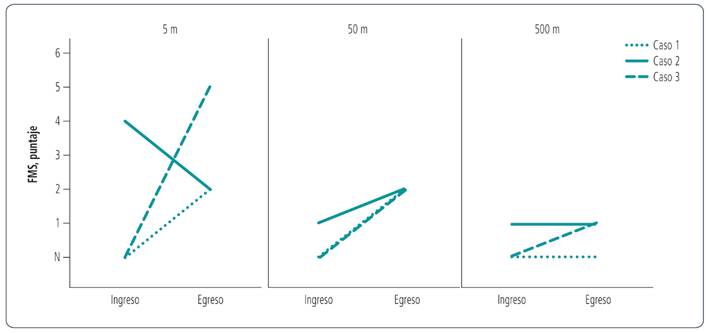
Figura 2 Evaluación de la movilidad funcional al ingreso y egreso del centro rehabilitación en tres distancias específicas: hogar (5 m), escuela (50 m) y comunidad (500 m), según la escala de movilidad funcional (FMS).
En las imágenes obtenidas luego de la rehabilitación, se evidenció resolución completa de las lesiones isquémicas con remodelado de fosa posterior y del IV ventrículo (Figura 3). Al egreso (3 meses y 15 días), se evidenció un cambio de 23 puntos en la SARA con mejoría en todos los ítems. Con respecto a la FMS, se observó una mejoría de 2 categorías en distancias cortas y medias, aunque sin cambios en distancias largas. Es decir, marchaba con andador posterior en distancias de 5 y 50 metros, según su bajo umbral de fatiga muscular, y era trasladado en silla de ruedas en distancias de 500 metros.

Imágenes ponderadas en T2 antes y luego de la rehabilitación. Paciente 1 (a y d) con resolución de los cambios de señal en T2 que rodean el lecho y mayor retracción ventricular. Paciente 2 (b y e) con mayor efecto retráctil con reducción del tamaño del IV ventrículo (interrumpe con colocación de válvula de derivación ventrículo peritoneal, mínima profundización interfoliar). Paciente 3 (c y f) con mínima profundización interfoliar.
Figura 3 Comparación entre RM postquirúrgicas y postrehabilitación.
Caso 2
Ante cuadro de ataxia y vómitos, se solicitó RM de cerebro, que evidenció voluminosa lesión en fosa posterior, de localización vermiana, asociada a una lesión metastásica en región selar. Se realizó una tercer ventriculostomía, en conjunto con exéresis macroscópicamente completa de lesión de fosa posterior, con un líquido céfalo raquídeo negativo, pero se evidenció realce leptomeníngeo a lo largo del neuroaxis. En las imágenes postquirúrgicas ponderadas en T2, se observó gliosis de la cavidad quirúrgica con retracción parenquimatosa, amplia resección de núcleos dentados y lesiones isquémicas alrededor del lecho quirúrgico.
Evolucionó en postoperatorio con SFP. Realizó radioterapia craneoespinal tipo IMRT a 36 Gy con boost de 56 Gy en lecho y en lesión metastásica, junto con 6 dosis de vincristina semanal. En la mitad del tratamiento, el paciente evolucionó con síntomas de hipertensión endocraneana y fue sometido a la colocación de una válvula de derivación ventrículo peritoneal (Ve-Pe). Finalizó radioterapia con RM de cerebro y columna con remisión completa de las lesiones, sin evidencia de residuo y aclaramiento del componente leptomeníngeo.
Al ingreso a rehabilitación, el cuadro motor se comportó como una cuadriparesia atáxica a predominio derecho. Además, presentaba debilidad muscular generalizada, así como dismetría, temblor, adiadococinesia, mutismo, inestabilidad emocional e irritabilidad (puntaje SARA 16,5).
A nivel axial, presentaba control cefálico y de tronco, lograba mantener la sedestación de manera independiente y lograba acceder a la bipedestación con asistencia. En cuanto a la FMS, lograba caminar distancias cortas, utilizando el mobiliario o la mano de un adulto como apoyo, y en distancias medias y largas era usuario de silla de ruedas. En la marcha, se observaba marcada inestabilidad, amplia base de sustentación, incoordinación en los pasos y tendencia a lateralizar hacia la izquierda.
Al finalizar la rehabilitación, las imágenes mostraron resolución completa de las lesiones isquémicas previamente mencionadas con remodelado de fosa posterior y del IV ventrículo. En la evaluación de egreso (a los 19 días), se evidenció un cambio de 2 puntos en la SARA con una mejoría tanto en la marcha como en la postura. Con respecto a la FMS, se observó una mejoría en distancias cortas y medias, ya que progresaba a una marcha con andador posterior, aunque sin cambios en distancias largas.
Caso 3
Se presentó con convulsión tónico-clónica generalizada. La RM de cerebro evidenció lesión ocupante de espacio en fosa posterior, de localización en hemisferio cerebeloso, con impronta en IV ventrículo. La RM de columna no evidenció diseminación leptomeníngea. Se realizó resección parcial de la lesión. Inició rehabilitación motora durante 2 meses por un síndrome cerebeloso con hipotonía derecha y luego concurrió a nuestro nosocomio en segunda consulta para cirugía de remanente tumoral. Se realizó exéresis macroscópicamente completa, y en las imágenes postquirúrgicas ponderadas en T2, se observó gliosis de la cavidad quirúrgica con retracción parenquimatosa y una amplia resección de los núcleos dentados.
El cuadro motor al ingreso fue diagnosticado como hemiataxia derecha con alteración del control postural y debilidad muscular generalizada a predominio derecho. A nivel de miembro superior derecho, presentaba temblor intencional, adiadococinesia y dismetría y, a nivel de miembro inferior derecho, se observaba debilidad muscular con presencia de incoordinación muscular y dismetría en la marcha. Lograba mantener la sedestación con apoyo y requería moderada asistencia para las transiciones posturales y transferencias (puntaje SARA 12 puntos). En cuanto a la FMS, era usuario de silla de ruedas, pero con incapacidad para autopropulsarse en las 3 distancias evaluadas.
En la evaluación luego de la rehabilitación, las imágenes mostraron resolución completa de las lesiones isquémicas previamente mencionadas con remodelado de fosa posterior y del IV ventrículo (Figura 3). Al egreso (8 meses), se evidenció un cambio de 2,5 puntos en la SARA con mejoría principalmente en la marcha, la sedestación sin apoyo y el señalamiento con el dedo. Con respecto a la FMS, se observó una mejoría en las 3 distancias y logró la marcha de forma independiente en distancias cortas, con andador en distancias medias y mediante autopropulsión de la silla de ruedas en distancias largas. En ningún momento de la internación requirió tratamiento médico coadyuvante.
Discusión
En este estudio, hemos reportado la presentación y evolución de los estudios complementarios, las manifestaciones neurológicas y la movilidad funcional en tres niños que ingresaron a nuestra institución por desarrollar SFP luego de ser intervenidos quirúrgicamente para resección de TFP.
En relación a las imágenes postquirúrgicas, los tres niños evidenciaron amplia resección de los núcleos dentados. Considerando que en este sector discurre la vía dento-rubro-talámica, su disrupción podría asociarse a SFP.16 Los dos pacientes con meduloblastoma presentaron lesiones isquémicas alrededor del lecho quirúrgico. La paciente con astrocitoma pilocítico no evidenció esas lesiones. Dado que esta paciente tampoco presentó mutismo en su evolución, nos parece importante resaltar que para este caso no hemos contado con imágenes postquirúrgicas inmediatas, sino al mes de la cirugía.
En la evolución luego de la rehabilitación, las imágenes mostraron remodelado de fosa posterior y del IV ventrículo y resolución completa de las lesiones isquémicas previamente mencionadas en los casos con meduloblastoma. Si bien entendemos que los cambios ocurridos podrían estar vinculados a la evolución natural del evento quirúrgico, la buena recuperación clínica y funcional de los pacientes parece relacionarse a la remodelación de las estructuras del área en estudio. Se sugiere que la reducción del edema que afecta a los núcleos cerebelosos profundos es un predictor de recuperación temprana. A su vez, el factor tiempo es importante dado los cambios dinámicos en el entorno neuronal que se producen independientemente de cualquier rehabilitación.17) La rápida mejoría funcional durante el primer mes podría explicarse por la resolución esperada del edema en los primeros días/semanas.18
Con respecto a las manifestaciones neurológicas al ingreso, los tres pacientes presentaban, principalmente, ataxia. Esto es similar a lo informado por Hartely et al., quienes establecen que la ataxia es el principal problema motor en los niños con TFP intervenidos quirúrgicamente. La predominancia de esta también se acompaña de otras manifestaciones relacionadas: hipotonía, incoordinación de las extremidades, temblor, alteración de la marcha y deterioro del equilibrio.19)
Los dos primeros casos recibieron como tratamiento coadyuvante vincristina, agente quimioterápico que, según expone la literatura, podría ser responsable de cambios sensoriales y deterioro de la función motora, lo cual genera debilidad muscular y conduce a ataxia y compromiso de la marcha.20 Sin embargo, los efectos mencionados son poco frecuentes en niños. En comparación a estos dos casos, el caso 3 logró mayores cambios en la movilidad funcional y marcha independiente en distancias cortas. Esta diferencia podría explicarse en que no recibió tratamiento coadyuvante, ya que por la histología del tumor, el tratamiento es solamente quirúrgico y el pronóstico se basa principalmente en la resección completa.21) No obstante, presenta otras variables, como edad y sexo, que podrían explicar los cambios en los resultados observados.
Desde el punto de vista kinésico, la rehabilitación tiene como objetivo restaurar el movimiento y la función después de una lesión mediante el movimiento, el ejercicio y la terapia manual, así como brindar educación y asesoramiento.22 Por lo tanto, una buena evaluación permite un abordaje kinésico orientado a las limitaciones del paciente y, con ello, permite maximizar su independencia. Klein et al. señalan la importancia del uso del entrenamiento rehabilitador como herramienta para mejorar la reorganización cerebral y los resultados funcionales.17 La mejoría en la ataxia y movilidad funcional podría deberse a la recuperación y reparación de la función cerebral que se encuentran favorecidas y promovidas con la rehabilitación motora.19
Este estudio cuenta con limitaciones. En primer lugar, la SARA y la FMS son evaluaciones que no se encuentran validadas para la población en cuestión. En segundo lugar, tanto el escaso número de pacientes como el diseño metodológico imposibilitan establecer una relación causal; por lo tanto, es importante destacar que existen otros factores ajenos a la rehabilitación que podrían explicar los resultados observados. Finalmente, debemos destacar que los tres casos recibieron diferentes tiempos de rehabilitación. Según Küpper et al., los cambios clínicos más significativos ocurren en los primeros 6 meses postquirúrgicos.
Por otro lado, este estudio cuenta con fortalezas. Es el primer trabajo en nuestro país que ha abordado el tratamiento médico y la rehabilitación kinésica en niños con SFP. Es un tópico de gran interés y emergencia a nivel de la fisioterapia mundial, por lo que motiva a continuar esta línea de investigación.
Ante la escasa disponibilidad de escalas válidas en neuropediatría, sería relevante desarrollar investigaciones para traducir, adaptar y validar herramientas en esta población. Además, sería interesante identificar las características de los niños con diferentes potenciales de mejora, para así seleccionar apropiadas intensidades, dosificaciones y duración del tratamiento.18
Conclusión
Se describieron la presentación y evolución de los estudios complementarios, las manifestaciones neurológicas y la movilidad funcional en tres niños que ingresaron a nuestra institución por desarrollar SFP luego de ser intervenidos quirúrgicamente para resección del TFP. Al alta, los tres niños evidenciaron mejoría en las manifestaciones neurológicas, la movilidad funcional y los hallazgos en las imágenes.














