La reproducción es uno de los procesos indispensables para la persistencia de las especies en el tiempo y ha sido el principal objeto de estudio en la mayoría de las investigaciones sobre las aves (Martin 1987,
Wiens 1989, Martin et al. 2000). Los nidos cerrados son utilizados por un gran número de especies de aves para proteger huevos y pichones, convirtiéndose en imprescindibles para su reproducción (Cody 1971,
Newton 1998). Así, las cajas nido son construcciones artificiales muy útiles para facilitar estudios sobre la biología reproductiva en aves que usan oquedades para criar (Nilsson 1984, Purcell et al. 1997). Esta herramienta permite el monitoreo de huevos, pichones y adultos y el control de factores abióticos como las condiciones climáticas y la estructura del hueco y de factores bióticos como el parasitismo, la competencia y la depredación (Faaborg 2004, Lambrechts et al. 2010).
Una especie sudamericana que utiliza cavidades y depende casi exclusivamente de nidos realizados por otras aves para criar es el Coludito Copetón (Lep-tasthenuraplatensis). Esta ave es monógama y presenta cuidado biparental, reproduciéndose de septiembre a enero. A pesar de que existen algunos estudios sobre su biología reproductiva en las provincias argentinas de San Luis (Ochoa de Masramón 1969), Santa Fe, Córdoba (de la Peña 2016), Mendoza (Mezquida 2001), La Pampa (Pereyra 1937, Rebollo et al. 2013) y Buenos Aires (Mason 1985), en general es una especie poco estudiada a lo largo de su distribución. Dado que el Coludito Copetón utiliza sin dificultad las cajas nido para nidificar (de la Peña 2002, Reyes 2008, Rebollo et al. 2013), el objetivo de este trabajo fue estudiar su biología reproductiva en cajas nido en una población del bosque semiárido de caldén (Prosopis caldenia) de la provincia de La Pampa, un ambiente donde ha sido escuetamente estudiada.
MÉTODOS
Área de estudio
El área de estudio se encuentra dentro de la provincia fitogeográfica del Espinal, Distrito del Caldén, perteneciente al Dominio Chaqueño de la Región Neo-tropical (Fig. 1; Cabrera 1994, Oyarzabal et al. 2018). El clima es templado y semiárido, con precipitaciones estacionales de octubre a marzo con una media anual de 350-550 mm y una temperatura media anual de 14-16°C, con grandes amplitudes térmicas a lo largo del año (temperatura media de enero = 24°C; temperatura media de julio = 8°C; Cabrera y Willink 1973; Cano et al. 1980, Belmonte et al. 2017).
El muestreo se realizó en el establecimiento privado "La Tapera” (36°42’S; 64°32’O), al NO de la Provincia de La Pampa, Departamento Toay, distante a 30 km al oeste de la ciudad de Santa Rosa sobre la Ruta Provincial 14 (Fig. 1). Abarca una superficie de 5.5 km2, de los cuales 3 km2 presentan un bosque cadu-cifolio abierto de caldén en una matriz de gramíneas perennes intermedias, con escasos a nulos arbustos (Bragagnolo 2009). El establecimiento tiene uso ganadero de cría y mínimamente agrícola. Este estudio se realizó en un potrero con bosque de 0.97 km2 (Fig. 1), donde fueron instaladas las cajas nido.
Especie en estudio
El Coludito Copetón es un ave paseriforme perteneciente a la familia Furnariidae que es insectívora y residente (Remsen 2020). Se distribuye desde el sudoeste de Brasil y centro de Paraguay, a través de Uruguay, hasta el centro de Argentina, habitando la periferia de bosques secos y estepas arbustivas (Cueto et al. 1997, Remsen 2020). El tamaño poblacional mundial no ha sido determinado, pero se ha descripto como poco frecuente y su estado de conservación es de Preocupación Menor (BirdLife International 2022). No presenta dimorfismo sexual aparente en el patrón de coloración de su plumaje ni tampoco en sus características morfológicas (Remsen 2020). Mide 16 cm, pesa 9.67 g y la coloración del plumaje es gris parduzco, presentando un notable copete en su cabeza (Alderete y Capllonch 2010, Remsen 2020).
Cría generalmente en nidos abandonados de otros furnáridos, principalmente del Hornero (Furnarius ru-fus), aunque también anida en huecos de árboles o de construcciones humanas y cajas nido (Pereyra 1937, Ochoa de Masramón 1969, Mason 1985, Mezquida 2001, de la Peña 2002, 2016, Reyes 2008). Su ritmo de puesta es alterno (de la Peña 2016). Su tamaño de puesta varía de 2 a 4 huevos, pudiendo nacer los 4 pichones, aunque existen registros de puestas extraordinarias de 5 y 6 huevos y el nacimiento de hasta 5 pichones (Pereyra 1937, Ochoa de Masramón 1969, Rebollo et al. 2013). El período de incubación de los huevos es de 14-15 días y la permanencia de pichones en el nido es de 15.5 a 16 días (Mason 1985, Mezquida 2001, de la Peña 2016). Se desconoce la proporción de sexos, tanto en la puesta como en la nidada y la población.
Muestreo de campo
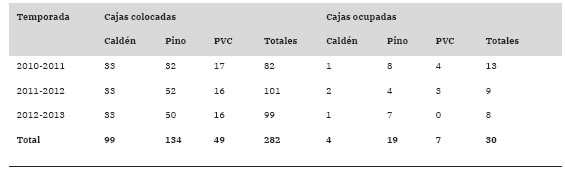
Para llevar a cabo el monitoreo de los nidos de Co-ludito Copetón, durante tres temporadas reproductivas se instalaron cajas nido siguiendo tres figuras lineales dentro del área de estudio. Las cajas fueron georreferenciadas mediante la utilización de un GPS y se colocaron distanciadas a 100 m una de otra, sobre el tronco principal de árboles de caldén a una altura de 1.6 ± 0.1 m del suelo. Se utilizaron cajas nido de madera de 35 x 27 x 14 cm, empleando caldén (Fig. 2a) o pino (Pinus sp., Fig. 2b), o cajas nido de tubos de PVC (Fig. 2c) de 13.5 cm de diámetro y 35 cm de largo, con tapas de madera de caldén superior e inferior. Todas las cajas presentaban una abertura de 3 cm de diámetro en la parte frontal. Se colocaron 82 cajas en la primera temporada reproductiva (2010-2011), 101 en la segunda (2011-2012) y 99 en la tercera (20122013; Tabla 1). Cada año, las cajas fueron revisadas cada 1-3 días desde septiembre hasta febrero registrando las fechas con presencia de huevos y pichones y su cantidad.
Figura 1: Ubicación del área de estudio en la provincia de La Pampa, Argentina. En línea de guiones negros se muestra el establecimiento “La Tapera” y en línea de guiones azules el potrero donde se colocaron las cajas nido.
Cuando los pichones tenían 12 días de vida (Fig. 3) se les extrajo una muestra de sangre de entre 5-20 UL de la vena yugular, con jeringas de 0.5 ml para insulina (Owen et al. 2011). Cada una de las muestras se conservó en un tubo Eppendorf rotulado con alcohol absoluto para su posterior sexado molecular en el laboratorio de la Facultad de Agronomía de la UNLPam. También se anilló a los pichones siguiendo procedimientos estándar (North American Banding Council y Fish and Wildlife Service 2003), usando anillos metálicos provistos de un código alfanumérico y dirección de remito correspondiente al Centro Nacional de Anillado de Aves (CNAA, Instituto Miguel Lillo, Tucumán). Finalmente, se los devolvió a su caja nido correspondiente.
Figura 2: Cajas nido colocadas en troncos de árboles de caldén desde las temporadas reproductivas 2010-2011 a 2012-2013 en el establecimiento “La Tapera”, provincia de La Pampa, Argentina. Las mismas fueron construidas con diferentes materiales a) madera de caldén, b) madera de pino y c) PVC con tapas superior e inferior de madera de caldén.
Figura 3: Pichón de Coludito Copetón anillado a los 12 días de vida, en el establecimiento “La Tapera”, provincia de La Pampa, Argentina.
Parámetros reproductivos
Para cada temporada reproductiva se calculó el porcentaje de ocupación de las cajas por parte del Co-ludito Copetón (número de cajas en que por lo menos había un huevo de la especie en estudio / número de cajas colocadas). Una vez detectada la construcción de un nido, se monitoreó para corroborar el período de reproducción, ritmo de puesta y contabilizar su contenido.
En aquellos eventos reproductivos sin segundas puestas o puestas de reposición, se estimó el período de incubación como el número de días desde la puesta del último huevo hasta el nacimiento del último pichón y la permanencia de los pichones en el nido como el número de días desde la eclosión del último huevo hasta la partida del último pichón. Cuando no se pudo determinar la fecha de eclosión y de abandono del nido por parte de los pichones por observación directa, se lo hizo en forma indirecta. Se consideraron las dos fechas como el valor medio entre la última visita con huevos o con pichones, respectivamente, y la siguiente en la que ya se observaron pichones recién nacidos o la caja sin pichones, correspondientemente. Se contabilizaron el total de eventos reproductivos, los eventos de depredación (faltante de huevos o pichones con nido revuelto, cáscaras de huevo rotas o pichones muertos y lastimados dentro o bajo la caja nido o presencia directa de micromamíferos o indicios indirectos como heces u olor), los abandonos de puestas (puestas con huevos no eclosionados, pero sin signos de depredación), las puestas de reposición y las segundas puestas (aunque la pareja reproductora no estaba marcada, se consideró una segunda puesta cuando en el mismo nido ya se había producido al menos un volantón).
Se estimó el tamaño de puesta como el número de huevos en puestas completas. Se consideró una puesta completa si al volver a chequear, el número de huevos era el mismo y se corroboraba que estaban siendo incubados (salía un adulto de la caja o estaban calientes). Se estimó la cantidad de huevos eclosiona-dos y de pichones que volaron (i.e., si luego de 14-15 días de eclosionados los huevos, al volver a chequear ya no se encontraban los pichones en el nido y no se comprobaban signos de depredación).
Se registró la fecha de hallazgo del nido activo (con huevos o pichones), la fecha de inicio de la puesta (puesta del primer huevo), la fecha en que se registró el nido activo por última vez y la fecha de la última visita al nido en la cual ya se constataba su destino final de éxito o fracaso. Con las fechas mencionadas, se calculó la tasa de supervivencia diaria del nido y el éxito de nidificación, elevando la tasa diaria de supervivencia al número de días del período reproductivo (Dinsmore et al. 2002, Rotella et al. 2004). Se obtuvo la proporción de sexos en pichones sólo de los nidos en los que se pudo sexar la nidada completa.
Análisis de Laboratorio
Para llevar a cabo el sexado molecular se imple-mentó la metodología propuesta por Ellegren y Shel-don (1997), que consiste en técnicas moleculares basadas en la amplificación mediante Reacción en Cadena de la Polimerasa de fragmentos de los genes CHD1-Z y CHD1-W. Dichos genes están localizados en los cromosomas sexuales y su amplificación es de aplicación universal para las aves, con la excepción de las ratites (Ellegren 1996, Fridolfsson y Ellegren 1999). Fueron utilizados los cebadores conservados 2550F (5’ GTTACTGATTCGTCTACGAGA-3’) y 2718R (5’-ATTGAAATGATCCAGTGCTTG-3’; Ellegren y Shel-don 1997, Fridolfsson y Ellegren 1999).
Análisis de datos
Los análisis estadísticos fueron realizados con R versión 4.0.4 (R Core Team 2021). La significación estadística se utilizó al 0.05. Se emplearon Modelos Lineales Generalizados con distribución de errores binomial (Crawley 2015) para evaluar si la ocupación de las cajas fue explicada por la temporada reproductiva y por el tipo de caja nido (caldén, pino o PVC) y para determinar si la proporción de sexos secundaria por nido es la esperada por azar (Hardy 2002).
Para evaluar si el tamaño de puesta fue explicado por la fecha de puesta se empleó un modelo Poisson truncado en cero (Long 1997), empleando el paquete “countreg” (Kleiber y Zeileis 2016). La fecha de puesta fue estimada utilizando el día juliano como los días transcurridos desde el día 1 (20 de octubre) hasta la puesta del primer huevo de esa puesta.
Para estimar la tasa diaria de supervivencia del nido se empleó el paquete “RMark” (Laake 2013). Se contemplaron como variables explicativas el tiempo dentro de la temporada reproductiva (número de días desde el inicio de la temporada a los cuales comenzó el evento reproductivo) y la edad del nido (número de días desde que se inició la puesta de huevos hasta su destino final; Dinsmore etal. 2002, Rotella etal. 2004).
La construcción de modelos fue de “pasos hacia atrás” y para seleccionar entre los distintos modelos posibles se empleó el criterio de información de Akai-ke para muestras pequeñas (AICc). Todos aquellos modelos con AAICc < 2 fueron promediados empleando el paquete “Mu-MIn” (Barton 2009), obteniendo la importancia e intervalos de confianza de las variables explicativas (Burnham y Anderson 2004). A posteriori, se empleó un Test de Tukey para realizar las comparaciones múltiples de la variable cualitativa tipo de nido del modelo de ocupación de las cajas nido, empleando el paquete “multcomp” (Hothorn et al. 2008).
RESULTADOS
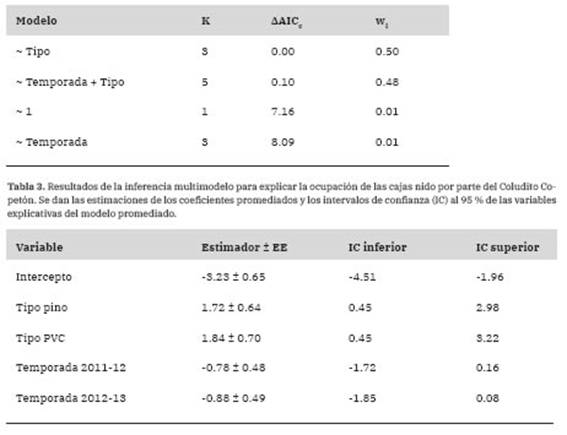
El porcentaje de ocupación total de las cajas nido por parte del Coludito Copetón en las tres temporadas reproductivas fue del 10.64% (Tabla 1). El resto de las cajas, en su mayoría, fueron ocupadas por parejas de Ratona (Troglodytes aedon). Los modelos que incorporaron la variable tipo de caja nido y tipo de caja nido + temporada reproductiva explicaron mejor la ocupación de las cajas por parte del Coludito Copetón que el modelo nulo o el modelo que solo incluyó la variable temporada reproductiva (Tabla 2). Al promediar los modelos, la importancia del tipo de caja fue alto (Importancia = 1) y la importancia de la temporada reproductiva fue baja (Importancia = 0.49). Además, sólo se encontró un efecto significativo del tipo de caja nido sobre la ocupación de las mismas (Tabla 3). Al realizar las comparaciones entre tipos de cajas nido, hubo evidencia de que las cajas de caldén fueron menos ocupadas que las de pino (Estimador ± EE = -1.67 ± 0.64, z = 2.62, p = 0.02) y PVC (Estimador ± EE = -1.83 ± 0.7, z = 2.61, p = 0.02), pero no hubo diferencias significativas en la ocupación entre las cajas de pino y PVC (Estimador ± EE = -1.17 ± 0.46, z = 0.36, p = 0.93).
El período de reproducción comprendió desde octubre a enero. La fecha de puesta más temprana del primer huevo fue el 20 de octubre (en 2010-2011) y la fecha más tardía de al menos un pichón en el nido fue el 29 de enero (en 2012-2013). El ritmo de puesta fue en días alternos (n = 20). La eclosión (n = 4) y el abandono del nido (n = 3) fueron sincrónicos, todos los huevos/pichones eclosionaron/abandonaron el nido el mismo día. El período de incubación abarcó 14.2 ± 1 días (n = 10) y la permanencia de pichones en el nido fue de 13.63 ± 2 días (n = 8). La duración promedio del ciclo reproductivo fue de 33 días (puesta alterna de en promedio 3 huevos que conlleva 5 días, más 14 días de incubación y 14 días de permanencia de pichones en el nido).
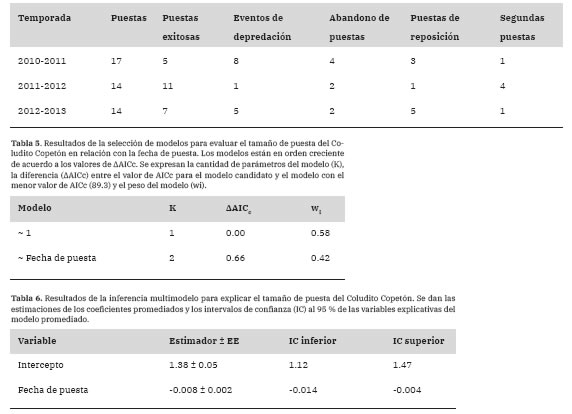
Existieron 45 eventos reproductivos (todos encontrados en la época de prepuesta o puesta) y se registraron de una a cuatro puestas por caja. Hubo 14 eventos de depredación registrados, 8 abandonos de puesta, 9 puestas de reposición y 6 segundas puestas (Tabla 4).
El tamaño de puesta fue de entre 2 y 5 huevos (media = 3.41, EE = 0.13, n = 34). El modelo que incorporó la fecha de puesta explicó peor el tamaño de puesta que el modelo en ausencia de esta variable (Tabla 5) y al promediar los modelos, la importancia de la fecha de puesta fue baja (Importancia = 0.42), pero hubo evidencia de que tuvo un efecto negativo sobre el tamaño de puesta (Tabla 6).
Por cada nidada completa, nacieron entre 1 y 5 pichones (media = 3.17, EE = 0.19, n = 24) y por cada nidada exitosa volaron también entre 1 y 5 pichones (media = 2.78, EE = 0.23, n = 23). Por evento reproductivo, se produjeron en promedio 1.42 volantones (EE = 0.23).
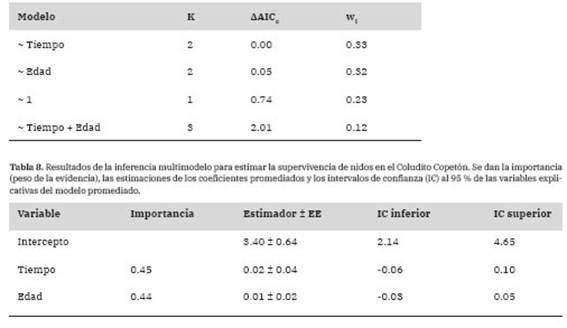
La tasa diaria de supervivencia del nido fue del 98.31 ± 0.51% (n = 29). Así, el éxito de nidificación fue del 56.92%, de acuerdo a la probabilidad acumulada de supervivencia de nidos durante los 33 días de duración promedio del ciclo reproductivo. Los modelos que incorporaron por separado el tiempo dentro de la temporada y la edad del nido explicaron mejor la tasa diaria de supervivencia del nido que el modelo nulo (Tabla 7). Sin embargo, al promediar los modelos, las importancias del tiempo y la edad fueron bajas y no hubo evidencia de que tengan un efecto sobre la supervivencia del nido (Tabla 8).
La proporción de sexos se pudo medir en 4 cajas nido de la temporada 2011-2012 y en 6 de la 20122013, donde en total hubo 15 pichones hembras y 15 machos. La proporción de sexos secundaria por nido no fue diferente de lo esperado por azar (Estimador ± EE = -0.69 ± 0.32, gl = 9, AIC = 22.7, IC al 95% de p = 0.27; 0.41). Ninguno de los pichones anillados fue observado criando en temporadas reproductivas posteriores.
DISCUSIÓN
Los aspectos de la biología reproductiva del Colu-dito Copetón estudiados aquí fueron muy similares a los descriptos en otras áreas de su distribución. Sin embargo, la tasa de supervivencia diaria de los nidos construidos en cajas nido fue aparentemente mayor que la encontrada en un estudio de nidos naturales en la provincia de Buenos Aires. También, se reporta por primera vez la proporción de sexos secundaria, la cual no fue diferente de lo esperado por azar.
El período de reproducción del Coludito Copetón comprendió cuatro meses, de octubre a enero, al igual que lo encontrado en Mendoza, Argentina (Mezquida 2001). Sin embargo, en Buenos Aires se reproduce entre octubre y noviembre (Mason 1985) y en las provincias de Santa Fe y Córdoba se reproduce de septiembre a diciembre (de la Peña 2016). Esto indica que esta especie comienza a reproducirse antes en zonas más al norte del país, lo cual podría deberse a que hacia el norte los ambientes son más húmedos y cálidos, presumiblemente con mayor disponibilidad de alimento (artrópodos) en el comienzo de la primavera (Messenger 1959, Cano et al. 1980). Además, esto coincide con el patrón general observado en aves, que presentan una reproducción más tardía en latitudes mayores (Baker 1939).
El ritmo de puesta fue alterno, al igual que lo encontrado en Santa Fe y Córdoba (de la Peña 2016), conñrmando este parámetro que había resultado dudoso en la provincia de Buenos Aires (Mason 1985). El tamaño de puesta abarcó de 2 a 5 huevos y se registraron hasta 5 pichones en una nidada, como ya había sido reportado previamente (Pereyra 1937, Ochoa de Masramón 1969, Rebollo et al. 2013). El tamaño de puesta disminuyó levemente conforme al avance de la temporada reproductiva, como se ha observado en otros paseriformes tanto del hemisferio Norte (Rowe et al. 1994, Verhulst y Nilsson 2008) como de Argentina (Massoni 2007, Segura et al. 2015). Esta relación temporal puede deberse a la capacidad de los reproductores y/o a la calidad del ambiente, en relación a la disponibilidad de alimento o la tasa de depredación (Verhulst y Nilsson 2008).
El Coludito Copetón mostró un período de incubación de 14.2 ± 1 días y un período de permanencia de pichones en el nido de 13.63 ± 2 días. Ambos parámetros concuerdan con los registrados en el resto de Argentina y demuestran que son aspectos constantes y característicos de la historia de vida de la especie (Mason 1985, Mezquida 2001, de la Peña 2016, Re-msen 2020).
La tasa diaria de supervivencia de los nidos (98%) fue aparentemente mayor que la encontrada por Ma-son (1985) en nidos naturales de la provincia de Buenos Aires, donde la supervivencia diaria de los nidos fue de 92%. La tasa diaria de supervivencia de los nidos describe al éxito de nidificación de una especie, el cual está determinado por factores bióticos y abióticos como son la condición física de los adultos, la disponibilidad y calidad de alimento y de sitios de nidificación, la presencia de depredadores y el clima, entre otros (Cody 1971, Newton 1998, Milenkaya et al. 2015, Rebollo et al. 2020). De este modo, son varios los factores que pueden explicar las posibles diferencias encontradas entre La Pampa y Buenos Aires.
En particular, las cajas nido ofrecen condiciones artificiales con respecto a los nidos naturales que pueden influenciar en los parámetros reproductivos (Nilsson 1984, Purcell et al. 1997). Por ejemplo, Nil-sson (1984) encontró que la depredación fue la principal causa del fracaso de nidos para cuatro especies de aves. En dos de estas especies detectó mayor depredación en nidos naturales que en nidos artificiales, mientras que en las otras dos especies la depredación fue similar en ambos tipos de nidos. En este caso, para el Coludito Copetón, las cajas nido podrían reducir la depredación (si bien esta fue documentada en 14 oportunidades). Por otro lado, la reproducción puede estar influenciada por la competencia (Edin-gton y Edington 1972, Weitzel 1988), que también es un modelador importante y evidente en nuestra área de estudio, donde la mayoría de las cajas fueron ocupadas por la Ratona. También observamos que la ocupación de las cajas por parte del Coludito Copetón fue diferente de acuerdo a las características constructivas, como el material y la forma, que podrían estar influenciando la selección de sitios de nidifica-ción, la competencia, la depredación y los parámetros reproductivos.
Para concluir, el presente estudio contribuye al conocimiento de la biología reproductiva del Coludito Copetón, ampliando el rango de estudio de esta especie a lo largo de su distribución. La mayoría de los aspectos descriptos concuerdan con los de otras regiones evaluadas. Además, reportamos por primera vez la proporción de sexos secundaria por nido, que no fue diferente de lo esperado por azar, como ocurre en la mayoría de las aves (Mayr 1939, Clutton-Brock 1986). Sin embargo, en un futuro, sería conveniente realizar otros estudios a largo plazo que permitan analizar la incidencia de factores bióticos y abióticos en la reproducción de este furnárido, tales como la condición corporal de los individuos reproductores, la disponibilidad de alimento, la tasa de depredación, las condiciones ambientales y el tipo de nido natural o artificial, entre otros. Esto podría ser particularmente relevante para ambientes disturbados, teniendo en cuenta que la especie en estudio es sensible a la fragmentación (Dardanelli et al. 2006, Palacio 2016) y en la provincia de La Pampa es más abundante en sitios sin disturbar (Sosa et al. 2010). Por último, resaltamos la importancia de contribuir al conocimiento de la historia natural de las especies, que es crucial para determinar su estado de conservación, para predecir respuestas ante el cambio global y para la toma de decisiones en el diseño de distintas prácticas de uso y manejo de las especies y los ambientes que ocupan (Dayton 2003, Jiguet et al. 2007, Whelan et al. 2015).
AGRADECIMIENTOS
Por permitirnos trabajar en "La Tapera” a Patricia Primucci y Manuel Garialde. Por brindarnos el permiso de investigación correspondiente a la Dirección de Recursos Naturales, Gobierno de La Pampa. Por permitirnos el uso del laboratorio de Biología de la Facultad de Agronomía a la Ing. Carmen Torroba. Por su aporte de materiales de laboratorio a la "Fundación Ciudad de Santa Rosa”. Por su ayuda económica al Grupo Asegurador "La Segunda”. Por su trabajo voluntario en el campo y el laboratorio a M. Soledad Lié-bana, Verónica Cuaranta, Julieta Mallet, Rocío Barón, Ana Paula Mansilla, Iara Mansilla, Nuria Morrow, Luciano Echeto, Mariano Viana, José María Galea y Tomás Pagella. Por su ayuda en la ejecución de análisis de datos a James J. Roper, Igor Berkunsky y Carla Tro-fino Falasco. Por su contribución a mejorar la redacción, a tres revisores anónimos y a la editora asociada Bettina Mahler. Este trabajo formó parte de la tesina de grado de MER. LAB recibió una beca del PRH-PFDT de la Agencia Nacional de Promoción Científica y Técnica y la Universidad Nacional de La Pampa (20092013). En reivindicación de la educación universitaria argentina pública, gratuita y de calidad.
Tabla 1: Cajas nido colocadas y ocupadas por parte del Coludito Copetón, clasificadas según sus características constructivas en las tres temporadas reproductivas estudiadas en el establecimiento "La Tapera”, La Pampa, Argentina.
Tabla 2: Resultados de la selección de modelos para evaluar la ocupación de las cajas nido por parte del Coludito Copetón en relación con la temporada reproductiva y el tipo de caja nido (cal-dén, pino o PVC). Los modelos están en orden creciente de acuerdo a los valores de AAICc. Se expresan la cantidad de parámetros del modelo (K), la diferencia (AAICc) entre el valor de AICc para el modelo candidato y el modelo con el menor valor de AICc (186.0) y el peso del modelo (wi).
Tabla 4: Descripción de las puestas por temporada reproductiva que llevó a cabo el Coludito Copetón en cajas nido en el establecimiento “La Tapera”, La Pampa, Argentina.
Tabla 7: Resultados de la selección de modelos para estimar la supervivencia de nidos en el Coludito Copetón, de acuerdo al tiempo (número de días desde el inicio de la temporada a los cuales comenzó el evento reproductivo) y la edad del nido (número de días desde que se inició la puesta de huevos hasta su destino final). Los modelos están en orden creciente de acuerdo a los valores de AAICc. Se expresan la cantidad de parámetros del modelo (K), la diferencia (AAICc) entre el valor de AICc para el modelo candidato y el modelo con el menor valor de AICc (80.83) y el peso del modelo (wi).
Recibido: 7 de abril de 2022
Aceptado: 30 de agosto de 2022












 uBio
uBio