Introducción
Se han realizado diversos esfuerzos para superar el tratamiento de células somáticas con agentes químicos o biológicos y así facilitar la reprogramación o aumentar la capacidad de los ovocitos enucleados para inducir el proceso; para encontrar la etapa óptima de tiempo y ciclo celular para la enucleación, fusión y activación; así como para optimizar la activación y el período de cultivo in vitro19.
Las mayores limitaciones biológicas de la clonación fueron que las células somáticas son completamente diferenciadas, con patrones de expresión génica que se correlacionan con la función del tejido del cual se originaron.
Por esta razón, la mayoría de los investigadores concentraron sus trabajos en encontrar el tipo celular y las mejores condiciones de las células donantes para que la información genética pudiera ser reprogramada de forma eficiente en el citoplasto receptor, aumentan do la eficiencia de la clonación somática.
Hasta la fecha se han utilizado muchos tipos celulares como donantes de núcleo para la producción de animales clonados. Dolly fue creada a partir de la reprogramación del núcleo de una célula de glándula mamaria 18. Sin embargo, otros resultados exitosos incluyen la utilización de células de cúmulos 17, fibroblastos fetales y adultos 8,12 entre otras.
Por consiguiente, el presente trabajo tuvo como objetivo evaluar el impacto de la reprogramación celular (células de fibroblastos y cúmulos) en la producción de clones bovinos que permitan seleccionar el tipo de célula más eficiente como donante de núcleo en la clonación.
Material y métodos
Localización del estudio y materiales utilizados. El estudio se realizó en el Laboratorio Genescol S.A. (Colombia), con apoyo logístico de los investigadores del Laboratorio de Biotecnología Animal, Reproducción y Mejoramiento Genético del Instituto de Investigación en Ganadería y Biotecnología, Universidad Nacional Toribio Rodríguez de Mendoza (Perú).
Colecta de los ovocitos. Los ovocitos fueron recuperados de folículos de 3 a 6 mm por el método de punción. El contenido folicular fue depositado en tubos con medio de manipulación TCM199-HEPES suplementado con 50 μg/ml de gentamicina y 10% (vol/vol) de suero fetal bovino (SFB).
Maduración in vitro de ovocitos. Los ovocitos se maduraron en grupos de 25 en placas de cuatro pocillos con medio TCM199 tamponado con bicarbonato suplementado con 0,6 mM de glutamina, 0,2 mM de piruvato, 0,01 UI/ml de FSH y LH, 1 mg/ml de estradiol, 50 μg/ml de gentamicina, 10 ng/ml de factor de crecimiento epidérmico (EGF) y 10% de SFB a 38,5°C en 5% CO2 con humedad máxima por 21 horas.
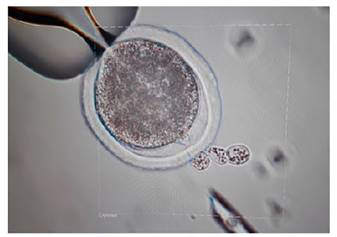
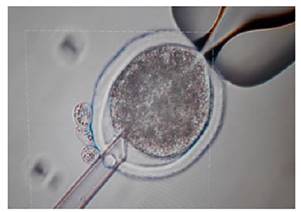
Preparación de citoplastos. Los óvulos maduros se incubaron en una solución de hialuronidasa de 0,3 mg/ml, seguidos de una agitación vorticial durante 6 minutos. Se confirmó la enucleación mediante tinción usando Hoechst 33342 y posterior visualización bajo luz UV. Para la manipulación se utilizó un par de micromanipuladores (Narishige, Japón) acoplados a un microscopio invertido (IX73, Olympus, Tokyo, Japón) y luz ultravioleta (filtro bloqueador UV-1a, con 365 nm de excitación y 400 nm de emisión) (Figuras 1 y 2).
Preparación de células somáticas. Las células somáticas fueron obtenidas de una vaca de la raza Gyr, siguiendo los protocolos establecidos por Tovar 14. Las células de cúmulos fueron extraídas directamente de los ovocitos recuperados por aspiración folicular guiada por ecografía (Ovum Pick Up-OPU, Easote, Italia). Las células fueron separadas por pipeteo constante y luego fueron cultivadas por 5 días (pase 0). Después se crioconservaron utilizando un procedimiento estándar (sistema Mister Frosty). Las células descongeladas con mínimo 24 horas de confluencia (G1 fueron utilizadas como donantes de núcleo para la reconstrucción embrionaria (Figura 3 - A y B).
Emparejamiento y electrofusión de célula donante con el citoplasto. Se emparejó una célula somática con un citoplasto. La fusión se realizó con un electrofusor BLS (Budapest, Hungría) y cámara de fusión (Modelo 450, 01-000209-01; BTX Corp, San Francisco, CA), en una solución de manitol a 0,3 M, 0,05 mM CaCl2, 0,1 mM MgCl2 y alcohol polivinilo (PVA) a 1 mg/ml inducida por un único pulso de corriente continua de 2 kV/cm por 9 gs. Los complejos fueron colocados en medio de retención con 20% de FBS durante 30 minutos para completar la fusión.
Activación y cultivo in vitro de embriones. Los embriones reconstruidos sin signos de lisis fueron incubados por 2 horas en medio TCM-bicarbonato con 10% de SFB en 5% de CO2 a 38,5°C para iniciar su reprogramación. Posteriormente estos fueron activados mediante incubación durante 5 minutos a temperatura ambiente en 7% de etanol en medio de mantenimiento suplementado con 20% de SFB, seguido de una incubación de 5 horas en el mismo medio suplementado con 5 μ/ml de citocalasina B y 10 μ/ml de cicloheximida a 38,5°C en atmósfera de CO2al 5%. Posteriormente, los embriones se cultivaron en placas de cuatro pocillos en medio SOFaaci 7 suplementado con albúmina bovina (BSA) al 0,3%. La placa de cultivo se selló en una bolsa hermética y se gasificó con una mezcla de aire que contenía 5% CO2, 5% O2y 90% de N2, para posteriormente ser incubado por 7 días a 38,5°C 15.
Transferencia de embriones y control de la preñez. Las transferencias se realizaron en el departamento de Santander (Colombia), en vacas receptoras sincronizadas con cuerpo lúteo de más de 16 mm de diámetro en uno de los ovarios. Se transfirieron los embriones al cuerno uterino ipsolateral del CL funcional con el uso de una pistola de transferencia de embriones (21”) con fundas punta de acero. La tasa de gestación se evaluó a los días 28, 60 y 75 mediante ultrasonografía.
Análisis estadístico. Los dos tipos de células somáticas fueron comparadas en función a la proporción de dobletes fusionados, producción de embriones clonados y permanencia de preñez. Para ello se aplicó una prueba «t» de Student para muestras o grupos de observaciones independientes, con un nivel de significancia de 0,05. Previamente se realizó una prueba de homogeneidad de varianza, además de haberse determinado el comportamiento normal de las observaciones.
Resultados
Un total de 3244 ovocitos de grados I y II fueron seleccionados para maduración, presentando cuerpo polar 89%, de los cuales se formaron 2887 complejos célula/cúmulos.
Se utilizaron dos líneas celulares (fibroblastos de piel adulta y células de cúmulos) para ser empleados como carioplastos (núcleo) y evaluar su impacto de reprogramación en la producción de embriones clones.
Se obtuvo una mayor eficiencia de reconstrucción con células de cúmulos (N°=168) a comparación con las células de fibroblasto, siendo la variación entre los dos tipos de células estadísticamente significativa (p<0,05; Tabla 1).
En total, se reconstruyeron 1285 citoplastos por transferencia nuclear de las dos células somáticas, sin embargo, solo entraron a cultivo el 76% (n=976). Se obtuvo una diferencia del 2% en los porcentajes de tasa de clivaje evaluado a los 2 días de cultivo in vitro, sin embargo, esta no fue significativa (p<0,05). Los porcentajes de blastocistos se registraron el día 7 de cultivo in vitro presentando una mínima diferencia porcentual, la cual no fue estadísticamente significativa (p<0,05; Tabla 2).
Se transfirieron 246 blastocistos viables de 7 días a 246 receptoras sincronizadas en el día 7 después de la ovulación, 113 embriones producidos a partir de fibroblastos de piel y 133 embriones producidos a partir de células de cúmulos (Tabla 3). Se evaluó permanencia de gestación a los 28 y 60 días sin encontrar diferencias significativas (p<0,05) entre los tipos de células utilizados para la reprogramación celular. Nuevamente se evaluó permanecía en el término de la etapa crítica del primer tercio de gestación (75 días), presentando diferencias significativas (p<0,05) en número y porcentaje con células reprogramadas de la granulosa (Tabla 3).
Discusión
La transferencia nuclear de células somáticas, originalmente propuesta a principios de 1900 como una forma de probar la retención de la potencia genómica durante la especialización celular, ahora se lleva a cabo en una gran cantidad de especies, utilizando diversas combinaciones de células núcleo donante-receptor y una amplia gama de metodologías 1.
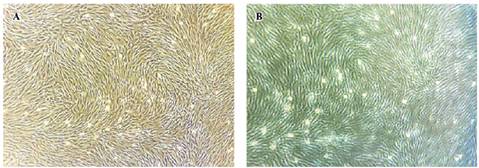
Figura 3 Fibroblastos de piel y células de cúmulos en cultivo in vitro. A) células de piel en confluencia. B) células de cúmulos en crecimiento.
Tabla 1 Citoplastos reconstruidos con fibroblastos de piel y células del cúmulos.
| células | 76.complejo 77. célula / óvulo (Nº) | 78.reconstruidos 79. (Nº) | 80.reconstruidos 81. (%) |
|---|---|---|---|
| fibroblastos de piel | 84.1487 | 85.556 | 86.37,4 ± 6,8b |
| células del cúmulos | 89.1400 | 90.724 | 91.51,7 ± 7,8a |
a,b superíndices diferentes dentro de columnas indican diferencia estadística (p<0,05).
Tabla 2 Desarrollo embrionario con fibroblastos de piel y células del cúmulos.
| células | 97.reconstruidos cultivados 98. (Nº) | 99.clivaje 100. (%) | 101.blastocistos 102. (%) |
|---|---|---|---|
| fibroblastos de piel | 105.427 | 106.71,1 ± 5,1 | 107.34,1 ± 10,0 |
| células del cúmulos | 110.549 | 111.73,1 ± 5,4 | 112.36,1 ± 8,4 |
a,b superíndices diferentes dentro de columnas indican diferencia estadística (p<0,05).
Tabla 3 Gestaciones generadas con fibroblastos de piel y células del cúmulos.
| células | 118.embriones 119. transferidos (n) | 120.receptoras (n) | 121.día 28 (n)(%) | 122.Permanencia 123. Día 60 (n)(%) | 124.día 75 (n)(%) |
|---|---|---|---|---|---|
| fibroblastos de piel | 127.113 | 128.113 | 129.52(46,0) | 130.28(24,8) | 131.8(7,1)a |
| células de cúmulos | 134.133 | 135.133 | 136.63(47,4) | 137.33(25,6) | 138.16(12,0)b |
a,b superíndices diferentes dentro de columnas indican diferencia estadística (p<0,05).
La capacidad de reconstrucción de la célula con el citoplasto y la reprogramación celular son factores primordiales para tener éxito en un proceso de producción de embriones clones, estos factores se ven influenciados por el tipo de célula utilizada como donante de núcleo (carioplastos) 11.
El estudio presentó mayor eficiencia de reconstrucción con células de cúmulos (51,7±7,8a) a comparación con las células de fibroblasto (37,4±6,8b), presentando diferencia estadísticamente significativa (p<0,05). Ello difiere del estudio realizado en el año 2017 con parte del mismo equipo de investigadores, donde no se encontraron diferencias estadísticas entre reconstruidos con células de fibroblastos y células de cúmulos (cumulus), lo cual podría estar influenciado por la técnica de clonación utilizada 2.
El porcentaje de reconstrucción de las dos líneas celulares utilizadas en la reprogramación para la formación de embriones clones se encuentra en el promedio (37,4%; 51,7%) de resultados reportados por otros autores con referencia a la técnica de clonación con micromanipuladores y HMC, independientemente de las células donantes 6,16.
La producción de blastocistos al día 7 de cultivo no se vio influencia da por la diferencia estadística en los porcentajes de reconstrucción, siendo los porcentajes de producción similares con la reprogramación de células de fibroblastos (34,1%) y células de cúmulos (36,1%), presentando una ligera superioridad con el empleo de células de cúmulos.
Tales resultados son similares a los reportados en un trabajo anterior 9, donde se evaluó la producción de embriones clones (blastocistos) generados a partir de células donantes de núcleos provenientes de diversos tejidos (adultos, fetales, pantorrilla, gametos femeninos y masculinos), no encontrándose diferencias en los porcentajes de producción.
Los promedios de producción de blastocistos de la investigación se encuentran dentro del promedio mundial (30%) de producción de blastocistos bovinos mediante transferencia nuclear somática con micromanipuladores 4.

Figura 4 Terneros clonados mediante la técnica de transferencia nuclear de células somáticas (SCNT). A: ternera Gyr Ofelia-C1, en el día del nacimiento. B) ternera Gyr Ofelia-C2.
Los resultados de esta investigación en permanencia gestacional evaluada a los 28 y 60 días- se encuentran dentro de los promedios > 50% de trabajos previos realizados 2,3, lo cual concuerda con otros autores 10, quienes obtuvieron un porcentaje de permanencia con células del cúmulus de 28% y piel de 50% en los primeros meses de gestación, y con porcentajes de nacimientos de 19% con células de cúmulus y 20% células de piel, conjuntamente se conoce que los embriones clonados presentan una tasa elevada > 60% de mortalidad embrionaria en el periodo de gestación temprana 5,13.
Ello concuerda con los resultados obtenidos a los 75 días de gestación donde la permanencia disminuyó en un porcentaje de 7,1% para embriones producidos a partir de la reprogramación de células de fibroblastos y 12,0% a partir de la reprogramación de células de cúmulos.
En conclusión, los estudios demostraron que las líneas celulares de piel y cúmulos son células que pueden ser utilizadas como donantes de núcleos para la clonación de terneros (Figura 4).
Sin embargo, es importante continuar con las investigaciones en biología celular para saber la procedencia exacta de las células donantes de núcleo, ya que podríamos estar utilizando fibroblastos todo el momento.